
Titrasi AsamBasa
VIVA - Tujuan titrasi asam basa mungkin perlu diketahui bagi kamu yang mempelajari mata pelajaran Ilmu Pengetahuan Alam (IPA). Pada kali ini kita akan membahas mengenai apa itu titrasi mulai dari pengertiannya, tujuan, prinsip hingga rumus. Kamu bisa mempelajari dan memahami pembahasan ini sebagai pembelajaran untuk menyelesaikan soal titrasi.

Titrasi Asam Basa Pengertian Cara Kerja Jenis Rumus Dan Contoh Soal Dengan Penjelasan Riset
Nah, sebelum gue lebih jauh membahas titrasi asam basa, rumus dan perhitungannya. Ada baiknya elo memahami dulu konsep dari titrasi asam basa. Titrasi asam basa adalah suatu prosedur yang dilakukan untuk menentukan konsentrasi atau kadar suatu zat yang tidak diketahui dengan menggunakan zat yang telah diketahui kadarnya (larutan standar).

Reaksi Asam Basa Rumus Kimia Contoh Soal Dan Jawaban Riset
Untuk menggunakan rumus titrasi asam basa monovalen, Anda perlu mengikuti cara perhitungan berikut ini: Masam x Vasam = Mbasa x Vbasa. Sedangkan rumus titrasi asam basa polivalen adalah. Masam x Vasam x valensi asam = Mbasa x Vbasa x valensi basa. Supaya lebih jelas, mari perhatikan contoh soal titrasi asam basa berikut: Sebanyak 50 mL larutan.
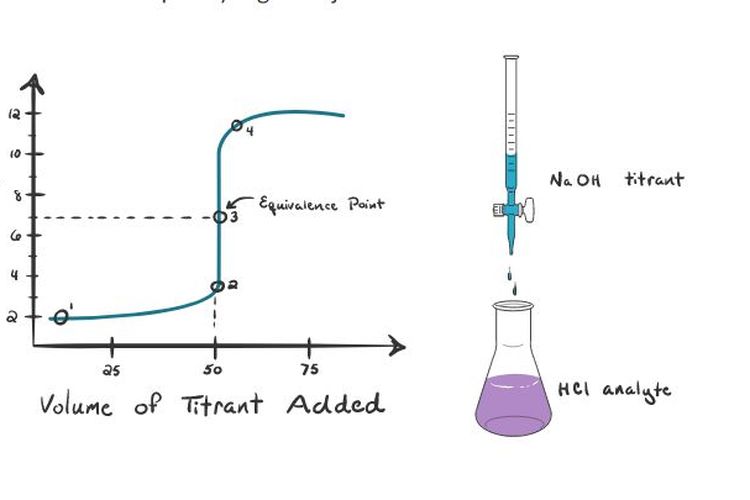
Foto Jenisjenis Titrasi Asam Basa
Dikutip dari modul Paket Keahlian Kimia Kesehatan oleh Kemendikbud (2016:47-48), adapun pengertian secara mendalam mengenai jenis titrasi asam basa sebagai berikut: 1. Titrasi asam kuat-basa kuat. Pada terjadinya proses titrasi asam kuat dan basa kuat, maka kedua larutan akan terionisasi secara sempurna.

Solusi Super Menyelesaikan Soal tentang Titrasi AsamBasa buat Kelas 11
Adapun rumus umum dari titrasi asam basa adalah sebagai berikut : adversitemens. Mol ekuivalen asam = mol ekuivalen basa. Dimana hal tersebut pada saat titik ekuivalen mol asam akan sama dengan mol basa. Ketika mol ekuivalen sudah didapatdari perkalian normalitas dan volume maka rumus diatas dapat diuraikan menjadi : N.V asam = N.V basa.
Mengenal Titrasi Asam Basa, Tujuan, Cara Kerja, Indikator, dan Pengertiannya Blog Mamikos
Jika valensi dari asam A dan basa B yang bereaksi diketahui, konsentrasi larutan asam/basa juga dapat dicari dengan rumus: Contoh Soal Titrasi Asam Basa Contoh Soal 1. Berapa konsentrasi dari larutan asam asetat CH 3 COOH jika diketahui untuk titrasi 25 mL larutan CH 3 COOH tersebut diperlukan 15 mL larutan NaOH 0,05 M agar mencapai titik ekivalen?

TITRASI ASAM BASA MASTER KONSEP KIMIA KELAS XI YouTube
Karena itulah kali ini kita akan membahas secara lengkap tentang titrasi asam basa, meliputi pengertian titrasi asam basa, cara kerja titrasi, rumus hitung dan contoh soal titrasi asam basa dengan penjelasannya. Reaksi asam dan basa membantuk suatu garam dan air yang menjadi salah satu ciri reaksi kimia yang umum di laboratorium. Hal ini karena.
Titrasi Asam Basa Larutan Definisi, Hasil, dan Juga Kedua Jenisnya!
Rumus Titrasi Asam Basa. Seperti yang sudah dijelaskan sebelumnya, titrasi asam basa bertujuan untuk mencari tahu konsentrasi dari larutan sampel yang dianalisis. Untuk menentukan konsentrasi larutan sampel, kamu bisa menggunakan rumus titrasi asam basa berikut: Keterangan:

Titrasi AsamBasa Kimia Kelas 11 • Part 1 Konsep, Stoikiometri, dan Cara Kerja Titrasi Asam Basa
Titrasi Asam Lemah dengan Basa Kuat. Dari kurva tersebut dapat disimpulkan: Baca juga: Rumus Segitiga: Luas, Keliling, dan Contoh Soal + Pembahasannya. Titik ekivalen berada di atas pH 7, yaitu antara 8 - 9. Lonjakan perubahan pH pada sekitar titik ekivalen lebih kecil, hanya sekitar 3 satuan, yaitu dari pH ±7 hingga pH ±10.

Titrasi AsamBasa
Jawabannya. HCl + NH 3 NH 4 Cl , maka valensi = 1. M a x V a = M b x V b. 0.105M x V a = 0.118M x 22.5mL. V a = 25.3 mL. Itulah tadi beberapa materi yang dapat dituliskan terkait dengan pengertian titrasi asam basa, cara kerja, macam, rumus perhitungan, contoh soal dan jawabannya. Semoga melalui ulasan ini bisa memberikan wawasan serta menambah.

10 Contoh Soal Titrasi Asam Basa Lengkap Dengan Kunci Jawaban dan Cara Mengerjakannya yang
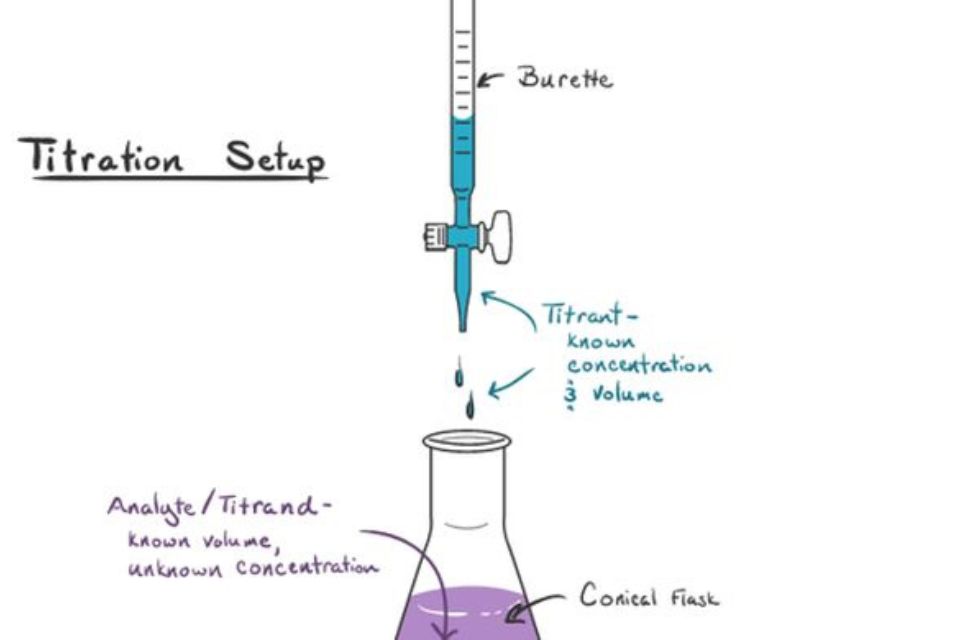
Titrasi Asam-Basa, Redoks, Kompleksometri, dan Karl Fischer. Secara prinsip, titrasi dibagi menjadi beberapa jenis namun 4 jenis berikut menjadi yang paling umum dilakukan, yaitu: Titrasi Asam Basa. Titrasi ini merupakan suatu metode penentuan suatu larutan asam dengan larutan basa yang telah diketahui kadarnya, atau sebaliknya.

Titrasi Asam Basa
Latihan Soal Titrasi Asam Basa (Sukar) Sebanyak 1,5 gram sampel batuan mengandung kalsium karbonat (CaCO3) dipanaskan hingga hanya terdapat 1 gram padatan. Padatan ini kemudian dilarutkan ke dalam air sehingga terbentuk 20 cm3 larutan yang kemudian dititrasi dengan 1,25 M larutan HCℓ ternyata diperlukan 20 cm3.

Prinsip Kerja Titrasi Asam Basa
Titrasi Asam Basa melibatkan reaksi antara asam dengan basa sehingga akan terjadi perubahan pH larutan yang dititrasi. Metode ini disebut pula analisis volumetrik karena pengukuran volume berperan penting dalam proses titrasi. Larutan yang akan ditentukan kadarnya dalam titrasi disebut sebagai analit. Sementara itu, larutan yang telah diketahui.

Pada suatu percobaan titrasi asambasa untuk menentukan m...
Rumus asam basa. Rumus asam basa di bawah ini akan berguna saat pembuatan laporan praktikum titrasi asam basa. Sedikit informasi, titrasi asam basa adalah prosedur untuk menentukan kemolaran, kadar asam , atau basa berdasarkan netralisasi. Berikut ini adalah rumus asam basa yang sering digunakan dalam titrasi asam basa. Rumus umum: M = n/V

Contoh Soal Dan Pembahasan Titrasi Asam Basa IMAGESEE
Dalam titrasi asam-basa, reaksi kimia yang umumnya terjadi adalah reaksi netralisasi antara asam dan basa. Berikut adalah beberapa rumus yang relevan dalam titrasi asam-basa: Rumus Jumlah Ekivalen. Jumlah Ekivalen Asam = Jumlah Ekivalen Basa. Jumlah ekivalen zat adalah jumlah partikel reaktan yang dapat memberikan atau menerima satu mol ion H+.

Contoh Soal Dan Pembahasan Titrasi Asam Basa Jurnal Ilmiah Farmasi Riset
Menghitung konsentrasi sampel dengan titrasi asam basa. Perhitungan pada titrasi asam basa didasarkan oleh terjadinya ekuivalen, dimana kedua zat baik asam maupun basa habis bereaksi. Contoh pada reaksi. HCl (aq) + NaOH (aq) à NaCl (aq) + H 2 O (l) maka berlaku. 1 mol HCl = 1 mol NaOH. M HCl x V HCl = M NaOH x V NaOH. Untuk reaksi dengan.