
Massa atom relatif (Ar) H=1, O=16 ; tetapan Avogadro =6...
Isi Hukum Avogadro. Isi dari Hukum Avogadro adalah pada temperatur serta tekanan yang sama, volume yang sama dari seluruh gas mengandung molekul yang sama. Hukum Gay Lussac menyatakan perbandingan volume gas pada sebuah reaksi sesuai dengan koefisien reaksi gas tersebut. Untuk itu, ketika volume salah satu gas diketahui, maka volume gas lain.

Jika L adalah tetapan Avogadro maka jumlah atom oksigen d...
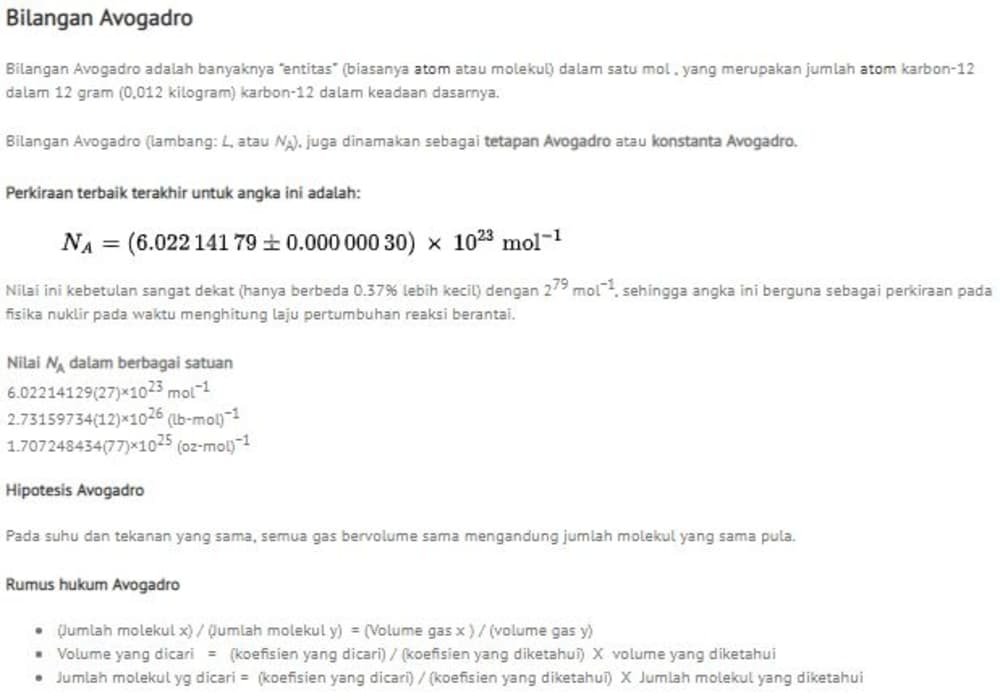
Bilangan Avogadro , juga dinamakan sebagai tetapan Avogadro atau konstanta Avogadro, adalah banyaknya "entitas" dalam satu mol, yang merupakan jumlah atom karbon-12 dalam 12 gram karbon-12 dalam keadaan dasarnya. Perkiraan terbaik terakhir untuk angka ini adalah:

Avogadro's Law Definition, Formula, Equation And Examples
Hukum Avogadro memiliki korelasi dengan hukum Gay Lussac tentang perbandingan volume unsur atau senyawa pereaksi dan hasil reaksi sesuai dengan perbandingan koefisiennya.. k = tetapan kesebandingan. Konstanta gas ideal memiliki nilai yang sama bagi semua gas. Keterangan: p1 = tekanan gas

Konsep Mol dan Tetapan Avogadro
Bilangan Avogadro adalah salah satu konstanta terpenting yang digunakan dalam kimia. Ini adalah jumlah partikel dalam satu mol bahan, berdasarkan jumlah atom dalam 12 gram tepat isotop karbon-12. Meskipun angka ini konstan, angka ini mengandung terlalu banyak angka penting untuk dikerjakan, jadi kami menggunakan nilai pembulatan 6,022 x 10 23. Jadi, Anda tahu berapa banyak atom dalam satu mol.
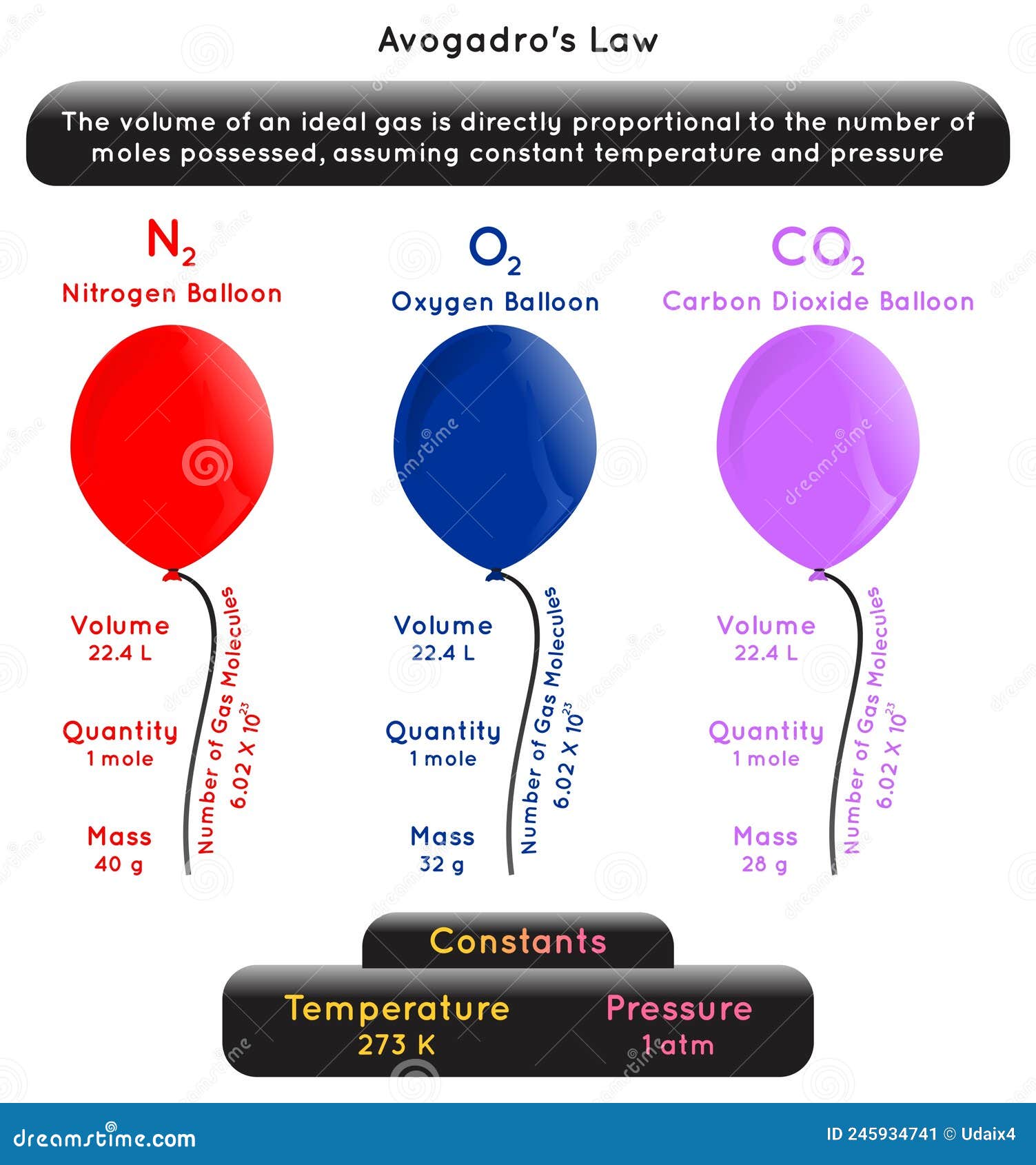
Avogadro Law Infographic Diagram with Example Stock Vector Illustration of mole, closed 245934741
Konsep Mol dan Tetapan Avogadro. Bilangan avogadro yang menyatakan banyaknya entitas dalam satu mol. (JONATHAN ATTEBERRY) KOMPAS.com - Kita telah mengenal atom dan molekul juga reaksi kimia yang terjadi. Reaksi pembentukan air diawali dengan pengikatan satu atom oksigen oleh dua atom hidrogen menghasilkan 1 partikel air.

Jika tetapan Avogadro adalah 6,02 x 1023 , maka jumlah i...
Soal dan Pembahasan. 1. Jika tetapan Avogadro = L, banyaknya atom Nitrogen yang terkandung dalam 1 gram gas Nitrogen adalah…. Jawaban: Tentukan jumlah mol (n) dalam 1 gram Nitrogen: n = massa N : Mr N. = 1 gram : 14. = 0,71 mol. Tentukan banyak partikel (X) Natrium dalam 0,71 mol konsentrasinya:
30+ Contoh Soal Hukum Dasar Kimia Avogadro Contoh Soal dan Jawaban
Sebelum lebih jauh membahas rumus dan contoh soal hukum Avogadro, ada baiknya elo mengenal dulu si jenius di balik hukum ini. Nama lengkapnya adalah Lorenzo Romano Amedeo Carlo Avogadro atau yang lebih dikenal dengan nama Amedeo Avogadro. Ia merupakan seorang ilmuwan dengan fokus di bidang fisika dan kimia yang lahir di Turin, Kerajaan Sardinia.

Persentase massa atom Cr (Ar = 52) dalam suatu mineral adalah 52. Jika tetapan
Tetapan Avogadro merupakan bilangan yang menunjukkan yaitu jumlah partikel dalam satu mol. Tetapan Avogadro dapat ditentukan dengan beberapa cara yaitu dengan cara elektrolisis, pemancaran partikel alfa oleh zat radioaktif, dan dengan cara struktur kristal. Pada penentuan dengan cara struktur kristal, diperlukan pengertian tentang volume sel.

PPT ZAT PADAT PowerPoint Presentation, free download ID3177334
Contoh Soal Konsep Mol Beserta Jawabannya. 1. Sebanyak 4,9 gram H2SO4 H 2 SO 4 dilarutkan dalam air sehingga diperoleh 500 mL larutan. Tentukan jumlah ion yang yang terlarut dalam larutan dan tentukan konsentrasi ion H+ H +. Jawaban contoh soal konsep mol dan penyelesaiannya. nH2SO4 = m Mr = 4, 9 98 = 0, 05 mol n H 2 SO 4 = m M r = 4, 9 98 = 0.

Tetapan Avogadro dan Konsep Mol YouTube
Pengukuran suatu massa biasa dinyatakan dalam satuan gram. Sedangkan massa atom atau molekul dinyatakan dalam satuan massa atom. Apakah kedua hubungan hal in.

Avogadro's Law Definition, Formula, Equation And Examples
Amedeo Avogadro. Bilangan Avogadro (lambang: L, atau N A), juga dinamakan sebagai tetapan Avogadro atau konstanta Avogadro, adalah banyaknya "entitas" (biasanya atom atau molekul) dalam satu mol, yang merupakan jumlah atom karbon-12 dalam 12 gram (0,012 kilogram) karbon-12 dalam keadaan dasarnya.Perkiraan terbaik terakhir untuk angka ini adalah: = Nilai ini kebetulan sangat dekat (hanya.

Jika nilai tetapan Avogadro N maka massa satu molekul pro...
Tetapan Avogadro merupakan konstanta yang digunakan untuk menghitung jumlah molekul dalam satu mol materi. Sejak ditemukan pada abad ke-19 oleh seorang ahli kimia Italia bernama Amedeo Avogadro, tetapan ini telah menjadi dasar penting dalam bidang kimia. Dalam prakteknya, tetapan Avogadro sering digunakan untuk menghitung berbagai volume gas dalam pengujian laboratorium.

Soal Jika tetapan Avogadro L = 6,02 × 10 23 dan Ar C = 12, O = 16 maka 22 gram gas karbondiok
Hukum Avogadro ( Prinsip Avogadro, atau Hipotes Avogadro) ialah hukum gas sesuai dengan ilmuwan Italia Amedeo Avogadro, yang pada tahun 1811 mengajukan hipotesis bahwasanya Gas-gas yang memiliki volume yang sama,tekanan yang sama dan pada temperatur yang sama , memiliki jumlah partikel yang sama pula. Artinya, jumlah molekul ataupun atom pada.

Konsep Mol Dan Tetapan Avogadro PDF
Jumlah besaran elementer tersebut disebut sebagai tetapan Avogadro dan dilambangkan dengan R. Besarnya tetapan Avogadro ditentukan secara eksperimen, dan harga tetapan Avogadro sebesar: 6,02 × 10 23 partikel. Hubungan Mol dengan Jumlah Partikel "Satu mol zat apapun akan memiliki jumlah partikel yang sama, yaitu sebesar 6,02×10 23 partikel.

Avogadro's Law Derivation, Application, Limitation
Lambang NA (Number Avogadro) adalah Tetapan Avogadro atau dalam bahasa Jerman disebut dengan Bilangan Loschmidt disingkat L yang besarnya adalah 6,02 × 10 23. Bilangan 6,02 × 10 23 adalah jumlah atom yang terdapat dalam 12 gram C-12, artinya untuk menentukan jumlah partikel digunakan standar mol, yaitu 12 gram C-12 sehingga 1 mol.

Contoh Soal Dan Jawaban Tentang Hukum Avogadro
Tetapan ini juga merupakan kombinasi dari konstanta hukum Boyle, Charles, Avogadro, dan Gay-Lussac. Secara fisik, kanstanta gas adalah konstanta kesebandingan terhadap kejadian yang menghubungkan skala energi dengan skala suhu, dengan mol partikel pada suhu dasar sebagai acuan.