Sifat Periodik Unsur di Dalam Tabel Periodik, Simak di Sini!
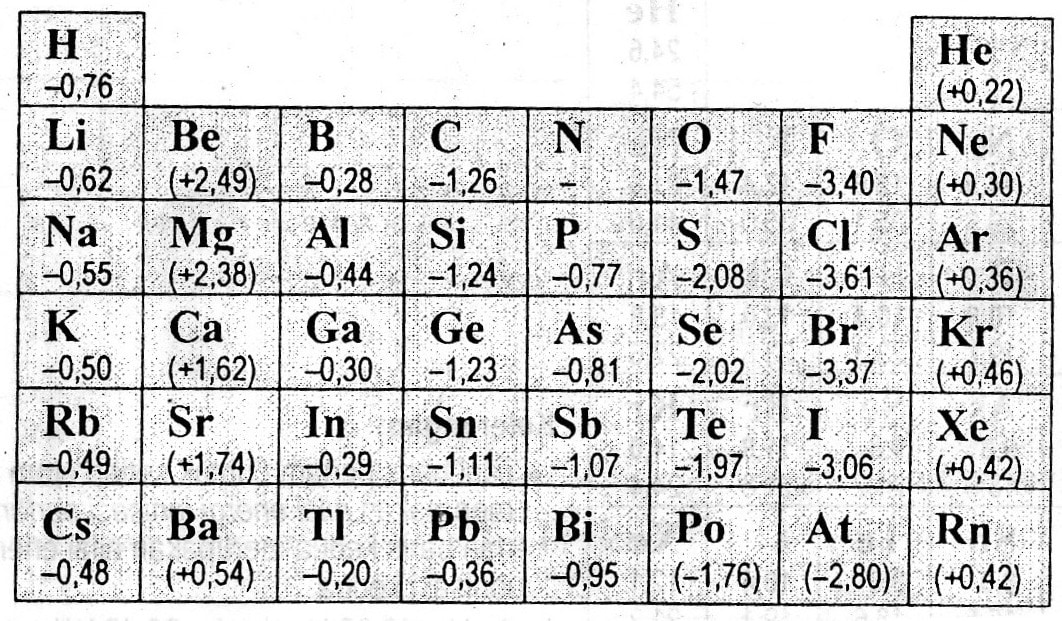
Pada tabel dapat kamu lihat bahwa keelektronegatifan fluor memiliki harga keelektronegatifan terbesar yaitu 4, artinya fluor paling mudah menarik elektron dari atom lain. Fransium dengan harga keelektronegatifan paling rendah yaitu 0,7 merupakan unsur yang sangat sukar menarik elektron atau lebih mudah melepaskan elektronnya.
Pengertian Sistem Periodik Unsur dan SifatSifat Pada Tabel Periodik Unsur Kimia Terlengkap
Tabel Periodik Keelektronegatifan. Tabel Periodik yang Dapat Dicetak Tabel periodik ini mencantumkan keelektronegatifan unsur.. Tabel Periodik Unsur Spanyol Esta tabla de colores para imprimir periódicos de los elementos que incluye el nombre del elemento, número atómico, símbolo, y el peso atómico..

PPT II. SISTEM PERIODIK UNSURUNSUR PowerPoint Presentation, free download ID6367356
Nah dalam sebuah Sistem Periodik Unsur terdafat sifat keperiodikan atau ciri khas perubahan nilai keelektronegatifan unsur, berikut ini adalah Sifat-Sifat Keperiodikan Unsur terhadap Keelektronegatifan. (Fr)) sampai dengan 4,0 (dimiliki oleh unsur Fluor (F)). Dibawah ini merupakan Skala Pauli atau Tabel Keelektronegatifan Unsur:
Tabel Sistem Periodik Unsur Kimia Lengkap Berbagai Unsur Images
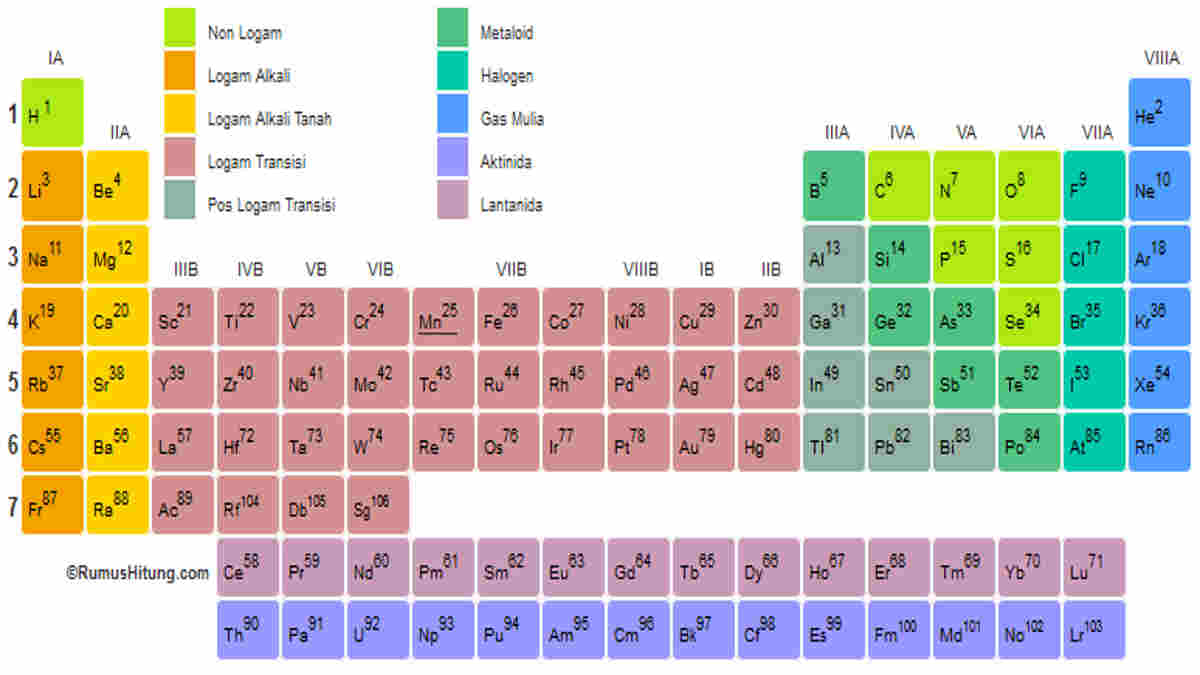
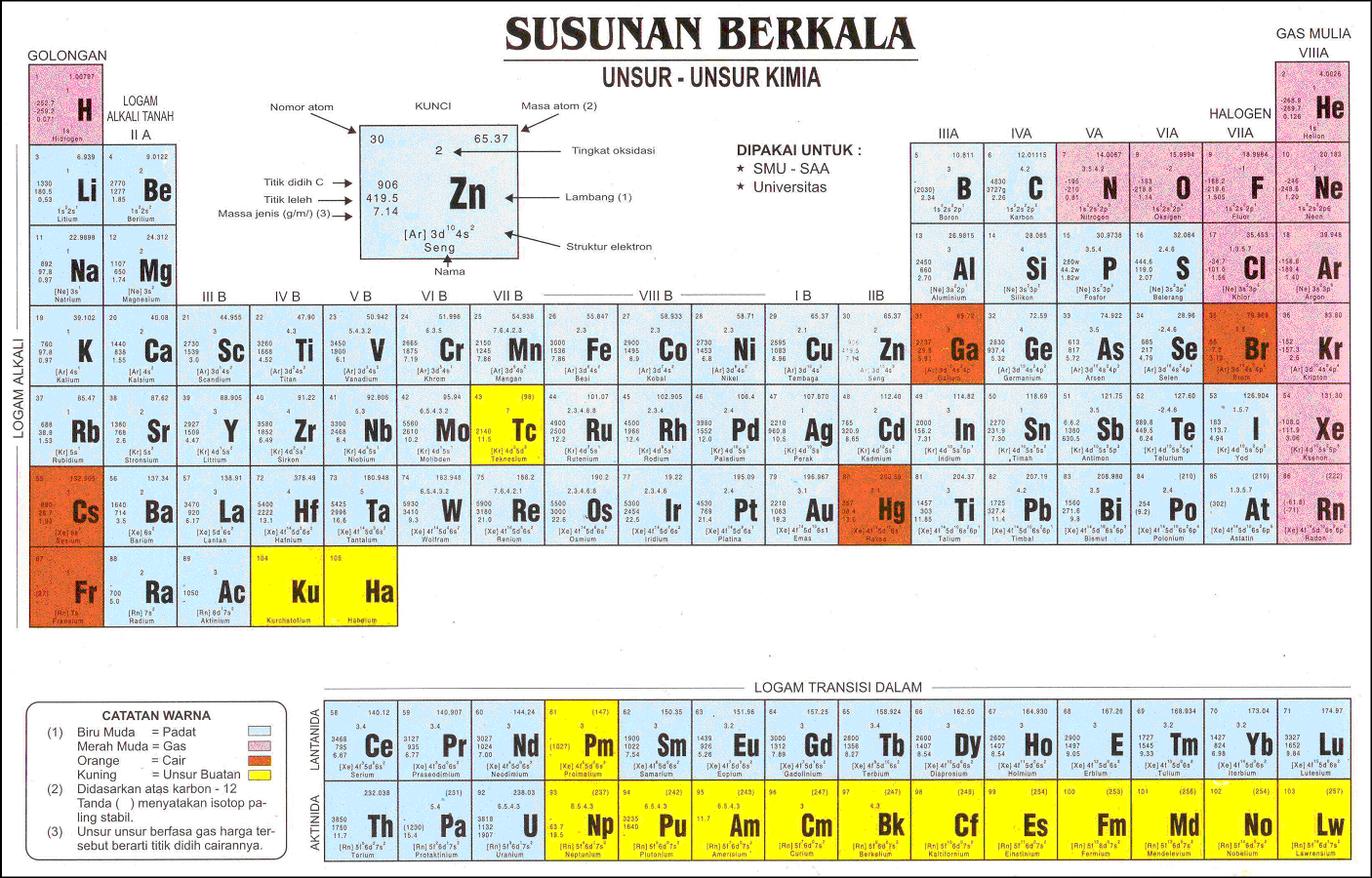
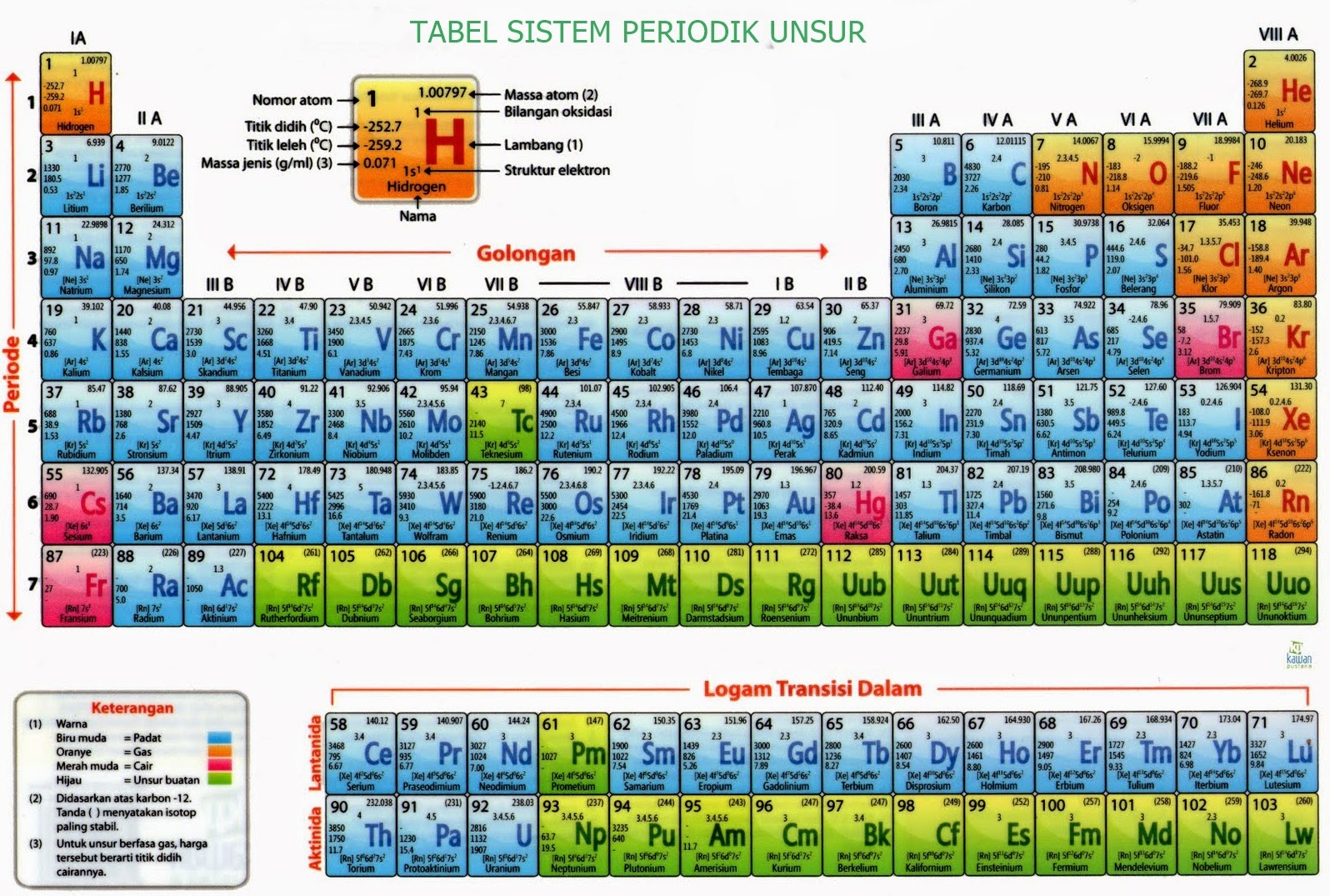
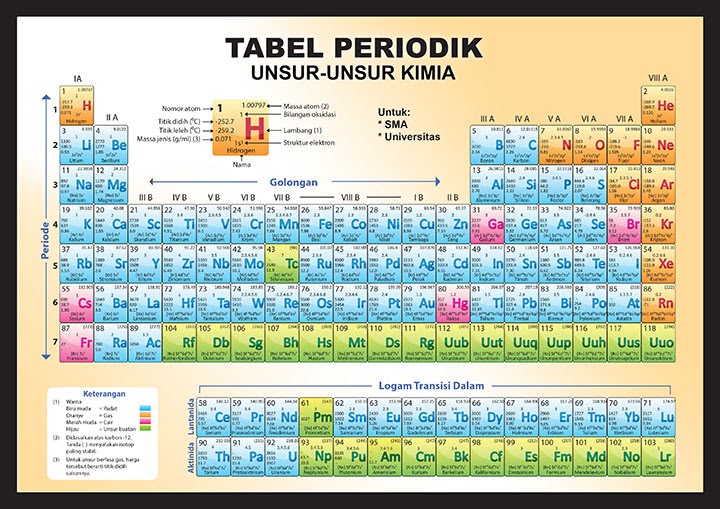
Sifat Keteraturan Tabel Periodik. Dalam tabel periodik, akan ditemukan angka-angka dengan keteraturan sifat unsur berdasarkan jari-jari atom, keelektronegatifan, energi ionisasi, logam dan non-logam dan juga afinitas elektron. Untuk bisa membaca dan memahami tabel periodik, ada baiknya detikers memperhatikan istilah-istilah di bawah ini: 1.
Tabel Sistem Periodik Sistem Periodik Unsur Kimia Tabel, Sifat, dan Gambar HD
Baca juga: Menentukan letak unsur dalam tabel periodik. 4. Keelektronegatifan. Pelajari Juga: Perkembangan Konsep Reaksi Reduksi Oksidasi (Redoks) Keelektronegatifan diartikan sebagai kemampuan suatu atom/unsur untuk menarik elektron valensi dari suatu molekul/ikatan. Kelektronegatifan dilambangkan dengan Skala Pauling.

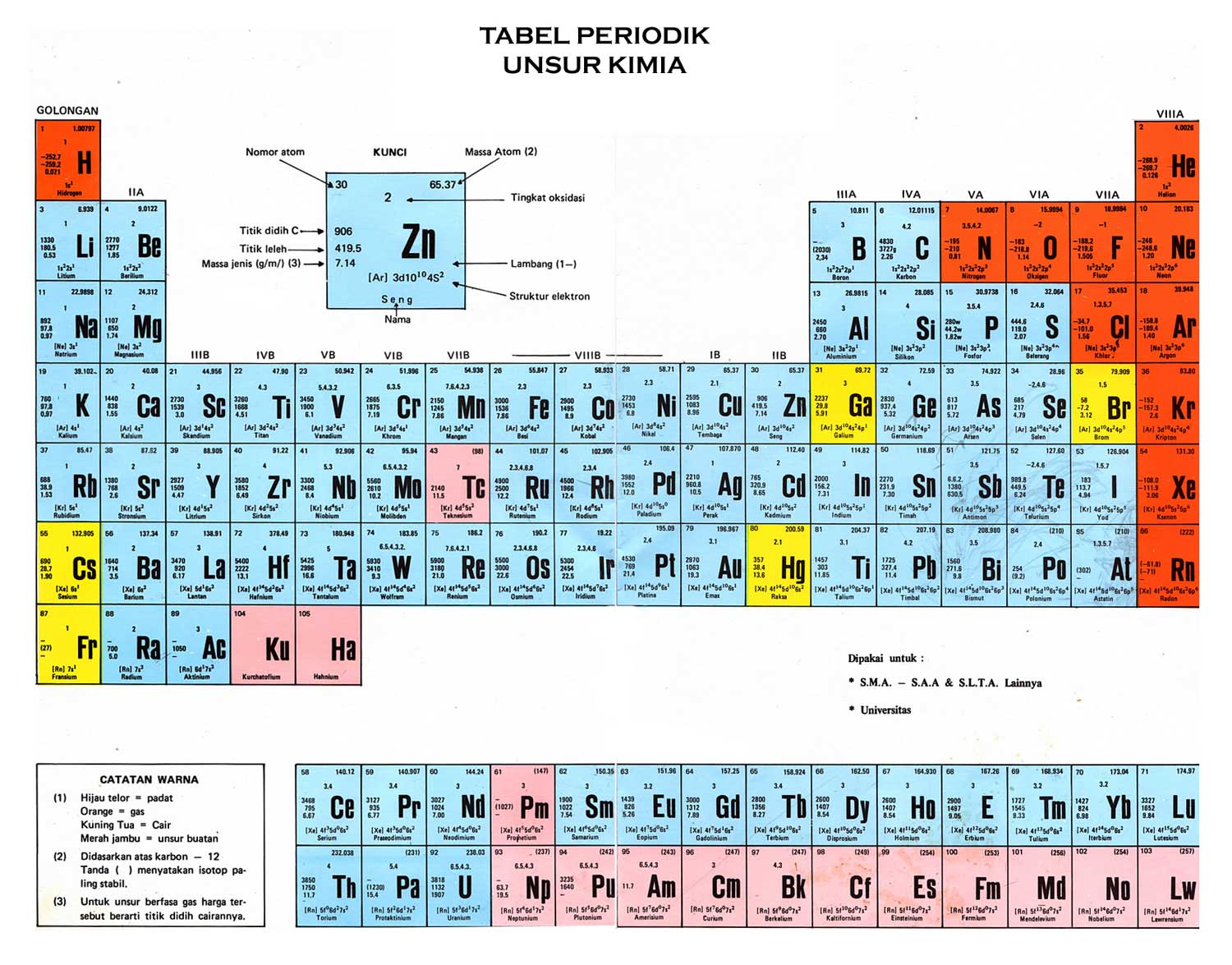
Tabel Periodik Unsur Kimia Lengkap
Pada video ini, kita bahas tentang sifat-sifat periodik unsur berdasarkan tabel periodik unsur. Topik ini merupakan lanjutan dari video sebelumnya tentang ko.
Menentukan Letak Unsur dalam Tabel Periodik Materi Kimia
Sifat periodik unsur meliputi sifat fisis (jari-jari atom, energi ionisasi, afinitas elektron, keelektronegatifan, dan kelogaman) dan sifat kimia (titik leleh dan titik didih). Sifat-sifat periodik unsur ini adalah sifat-sifat yang ada hubunganya dengan letak unsur pada sistem periodik. Sifat sifat tersebut berubah dan berulang secara periodik.

SISTEM PERIODIK UNSUR Soal dan Pembahasan Kimia
Unsur Mg terletak di sebelah kiri unsur P, sehingga keelektronegatifan P lebih besar. Unsur P dan As terletak dalam satu golongan, unsur P terletak diperiode 3 dan unsur As di periode 4, sehingga keelektronegatifan unsur P paling besar dari keduanya. . Dalam tabel periodik, unsur-unsur Na, Mg, Al dan S terletak dalam satu periode.
Tabel Sistem Periodik Unsur dan Penjelasannya Lengkap
Tren keelektronegatifan pada tabel periodik unsur (chem.libretexts.org) Sumber Chemistry LibreTexts,HyperPhysics Concept,Thought Co. Cari soal sekolah lainnya. KOMPAS.com - Keelektronegatifan adalah kemampuan atom menarik dan berikatan dengan elektron.
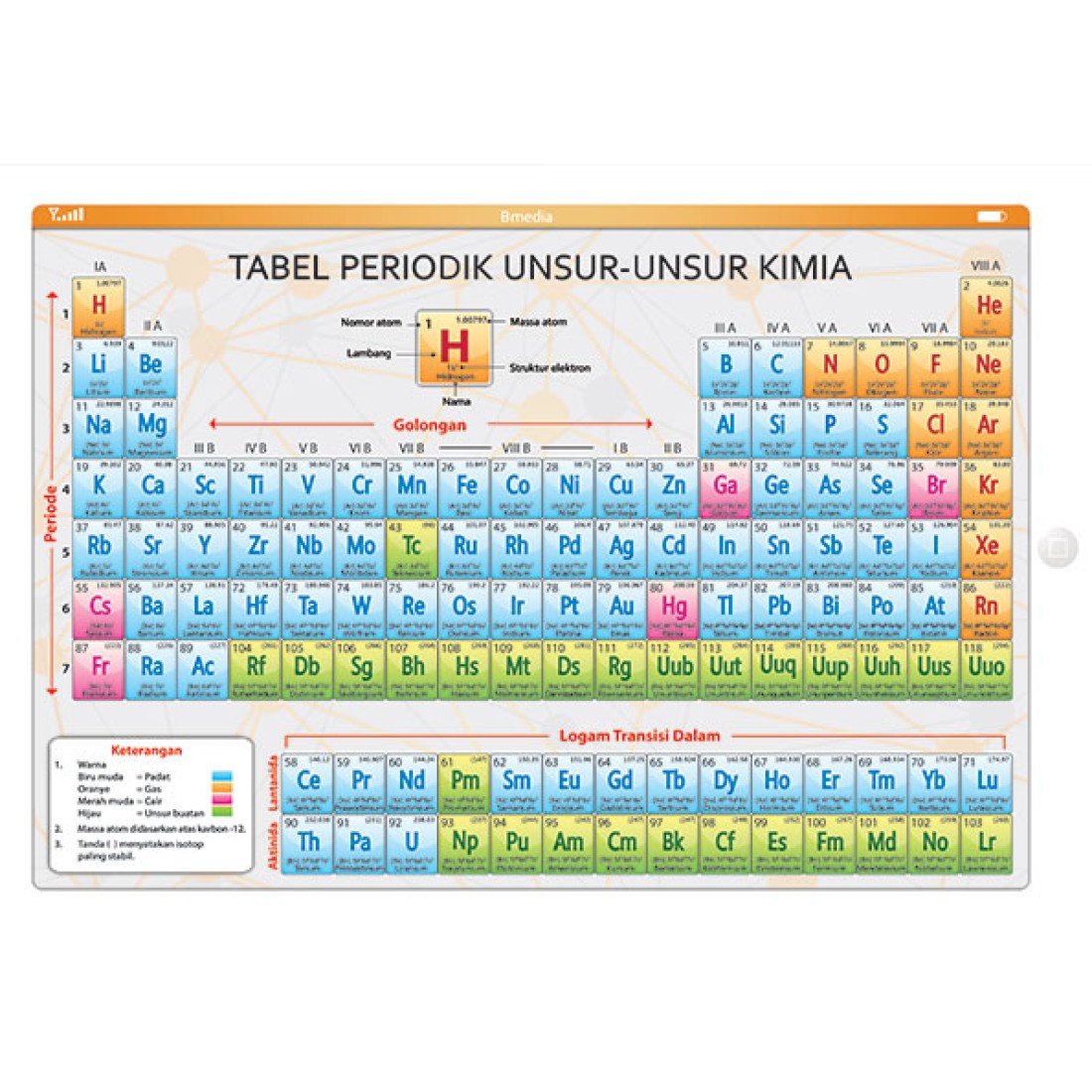
Tabel Periodik Unsur Kimia Pengertian, Gambar dan Keterangan Tabel Periodik Lengkap
Unsur Elektronegatif Terbanyak dan Terkecil. Unsur yang paling elektronegatif pada tabel periodik adalah fluor (3,98). Unsur yang paling elektronegatif adalah cesium (0,79). Kebalikan dari keelektronegatifan adalah elektropositif, jadi bisa dibilang cesium adalah elemen yang paling elektropositif.
Perkembangan tabel periodik unsur dan Sifat keperiodikan unsur
Elektronegativitas atau keelektronegatifan (Simbol: χ) adalah sebuah sifat kimia yang menjelaskan kemampuan sebuah atom (atau lebih jarangnya sebuah gugus fungsi). Sementara elektronegativitas naik sepanjang periode dalam tabel periodik, dan menurun sepanjang golongan, elektropositivitas menurun sepanjang periode (dari kiri ke.
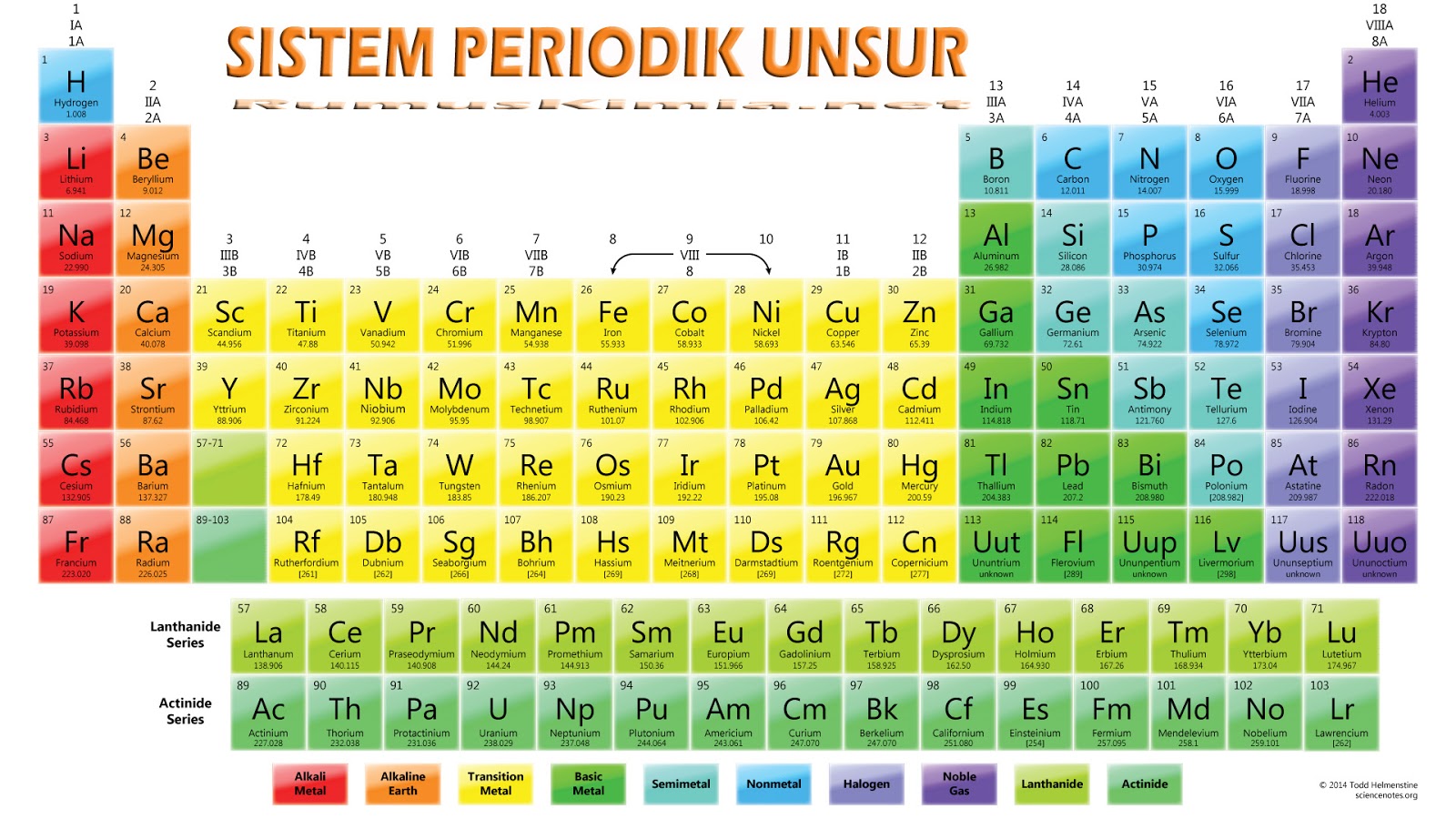
Sistem Periodik Unsur Kimia Rumus Kimia
Dilansir dari Chemistry LibreTexts, keelektronegatifan menurun ke bawah satu golongan karena pasangan elektron ikatan makin jauh dari gaya tarik inti. Seperti yang kita ketahui, atom dari atas ke bawah dalam suatu golongan memiliki jumlah elektron yang lebih banyak. Hal tersebut menyebabkan jari-jari atom tersebut lebih besar.
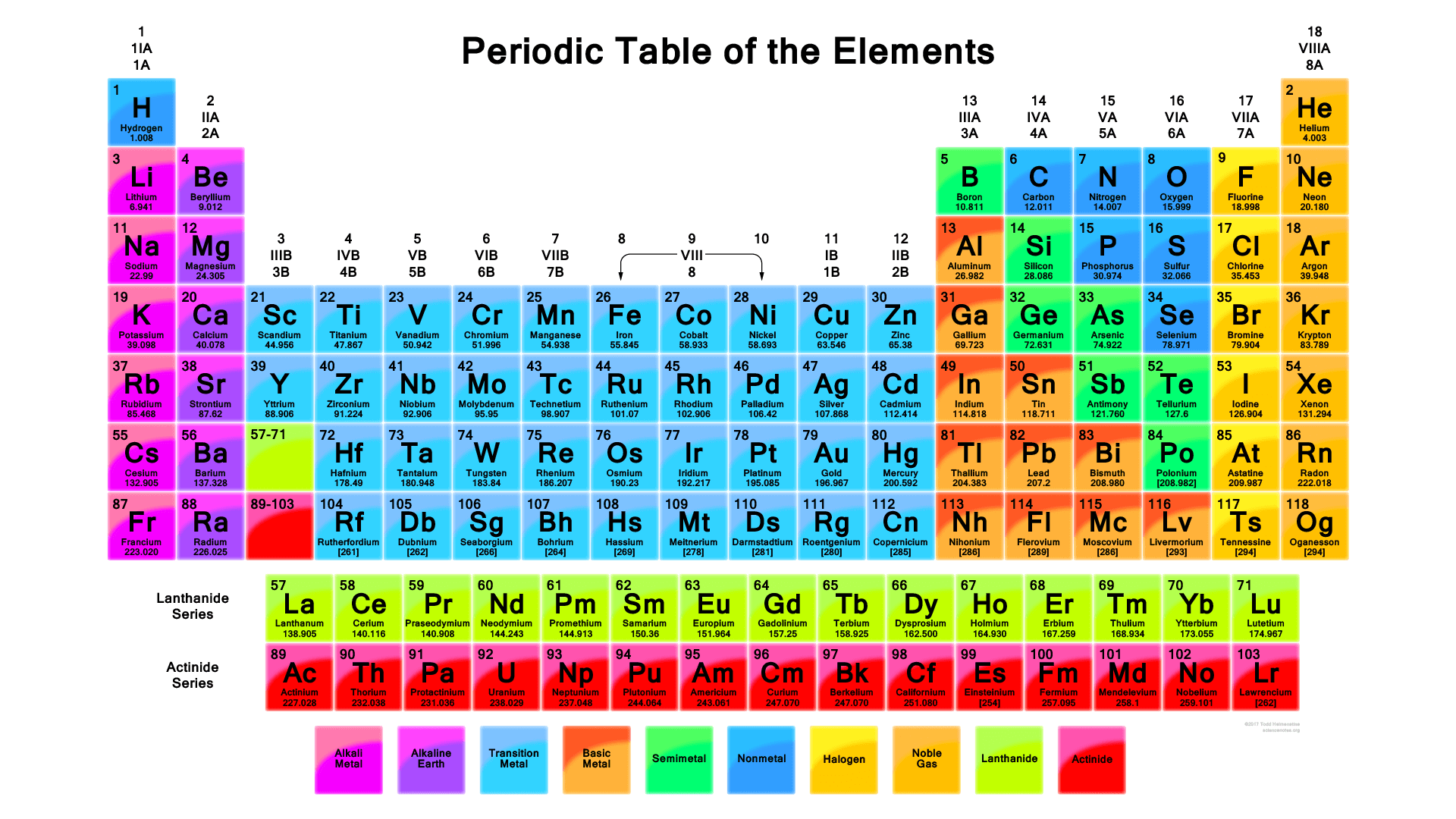
Tabel Periodik Unsur Kimia Lengkap (Gambar HD dan Cara Membaca)
Baca juga: Tabel Periodik: Pengertian dan Cara Membacanya. Keelektronegatifan suatu atom dipengaruhi oleh ukuran atom. Makin besar suatu atom, maka makin rendah keelektronegatifannya. Hal tersebut dikarenakan partikel yang bisa menarik elektron dalam suatu atom adalah proton yang bermuatan positif. Namun, proton berada di dalam inti atom.

Tabel Periodik Unsur Kimia (Pengertian & Cara Membaca) Guru Belajarku
Keelektronegatifan adalah salah satu tren tabel periodik. Cara umum untuk mengukur keelektronegatifan adalah dengan menggunakan skala Pauling. Linus Pauling adalah seorang ilmuwan Amerika yang memenangkan Hadiah Nobel untukkimia dan perdamaian. Skala keelektronegatifan Pauling dapat dilihat pada Gambar 1 juga. Gambar 1.

Tabel Sistem Periodik Unsur Dan Penjelasannya Lengkap Images and Photos finder
Ini adalah tabel periodik yang mencatat keelektronegatifan unsur-unsur. (Catatan: Keelektronegatifan tidak memiliki satuan.Linus Pauling adalah seorang ilmuwan yang merancang skala keelektronegatifan yang mengurutkan unsur-unsur relatif satu sama lain. Dan skala ini dikenal sebagai skala keelektronegatifan keelektronegatifan Pauling.) [1] Jika Anda belum mengetahui apa itu keelektronegatifan.
tabel susunan berkala atau sistim periodik tabel sistem periodik
Selain kedua sifat tersebut, masih ada satu lagi sifat periodik unsur yang menyatakan kecenderungan unsur dalam menarik elektron, yang disebut keelektronegatifan. Sekilas, ketiga istilah atau sifat tersebut memang terlihat sama, karena ketiganya membahas mengenai kecenderungan unsur dalam melepas atau menangkap elektron.