Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Dilansir dari Gramedia, asam basa merupakan larutan elektrolit yang dikenal sebab memiliki ciri khas masing-masing. Asam memiliki rasa yang masam, sementara basa memiliki rasa pahit dan teksturnya licin apabila dipegang. Baca Juga: Teori Asam Basa Menurut Para Ahli Beserta Contohnya. Agar lebih memahami materi berkenaan asam basa, simak contoh.

Get Contoh Soal Asam Basa Menurut Arrhenius Gif
Contoh Soal. 1. Tentukan manakah asam dan basa didalam reaksi asam basa berikut dengan cara memberikan alasan berdasarkan teori asam basa Brønsted-Lowry, Arrhenius, atau Lewis. Ni 2+ (aq) + 4CN - (aq) ⇌ [Ni(CN) 4] 2-(aq) Jawab: Teori Arrhenius serta teori Brønsted-Lowry tidak bisa menjelaskan reaksi diatas.

XI.6.q. Teori Asam Basa Lewis (Teori) YouTube
Berikut adalah contoh soal asam basa dalam bentuk pilihan ganda. Contoh soal asam basa ini telah kami lengkapi dengan kunci jawabannya. Selain itu, kamu juga bisa mendownload contoh soal asam basa ini lohh. Sehingga kamu akan lebih mudah mempelajari contoh soal asam basa ini. Soal No. 1 Menurut Arrhenius H2O bersifat netral karena.. . .

28+ Contoh Soal Reaksi Asam Basa Konjugasi Contoh Soal Terbaru
Berdasarkan teori asam basa Arrhenius, HCN adalah asam Arrhenius sebagaimana HCN akan melepaskan ion H + jika dilarutkan dalam air. Berdasarkan teori Brønsted-Lowry, HCN adalah asam Brønsted-Lowry karena mendonorkan proton (H + ) sehingga menjadi ion CN − sedangkan H 2 O adalah basa Brønsted-Lowry karena menerima proton sehingga membentuk ion H 3 O + .

Contoh Soal Dan Jawaban Asam Basa Konjugasi Jawaban Buku
Teori ini pertama kali dikemukakan oleh Ralph Pearson pada awal 1960-an dan merupakah salah satu teori asam basa menurut para ahli. Inti dari teori ini adalah menyatakan bahwa suatu asam lunak akan bereaksi lebih cepat dan membentuk ikatan yang lebih kuat dengan basa lunak, dan demikian pula sebaliknya untuk asam dan basa keras. Berikut ini.

Soal Essay Asam Basa Konjugasi
Jawab semua soal sulitmu seputar Teori asam basa dengan pembahasan dari Master Teacher Ruangguru. Cek di Roboguru sekarang!

Soal Soal Essay Asam Basa Kelas 11
Rangkuman 1 Teori Asam-Basa Arrhenius. Rangkuman 2 Teori Asam-Basa Arrhenius. Kuis Akhir Teori Asam-Basa Arrhenius. 675. 300. Materi pelajaran Kimia untuk SMA Kelas 11 IPA bab Teori dan Karakteristik Asam-Basa ⚡️ dengan Teori Asam-Basa Arrhenius, bikin belajar mu makin seru dengan video belajar beraminasi dari Ruangbelajar.

31++ Contoh Soal Tentang Asam Basa Konjugasi Contoh Soal Terbaru
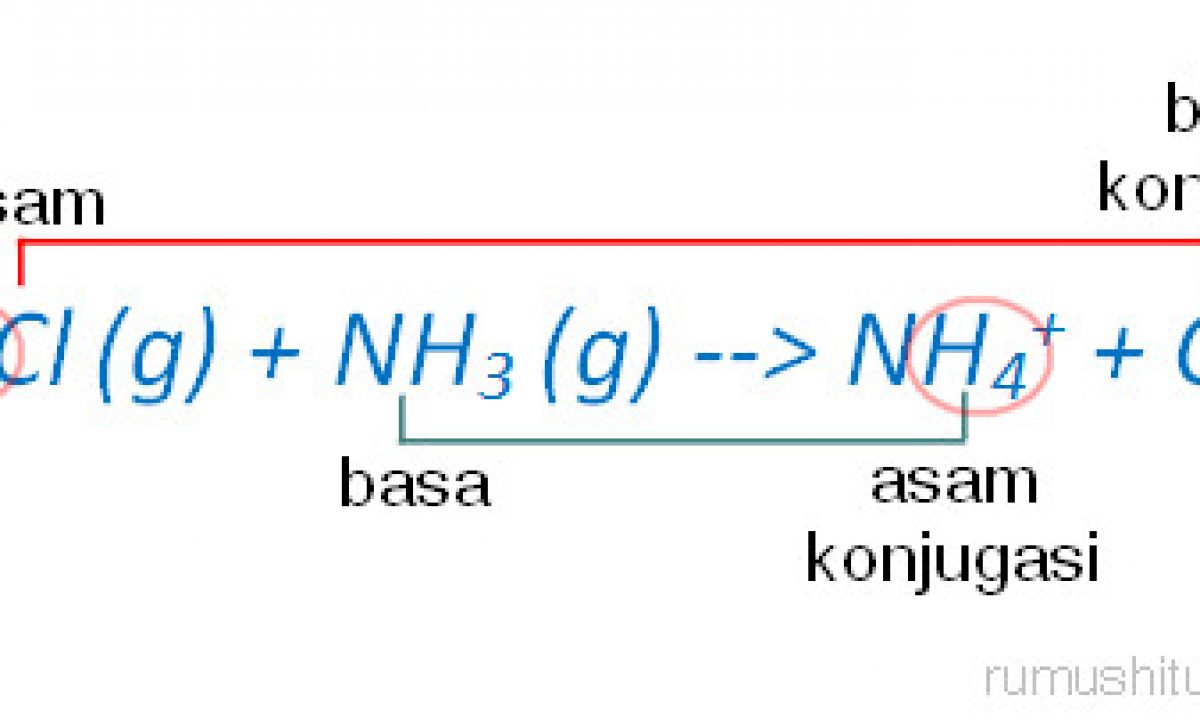
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
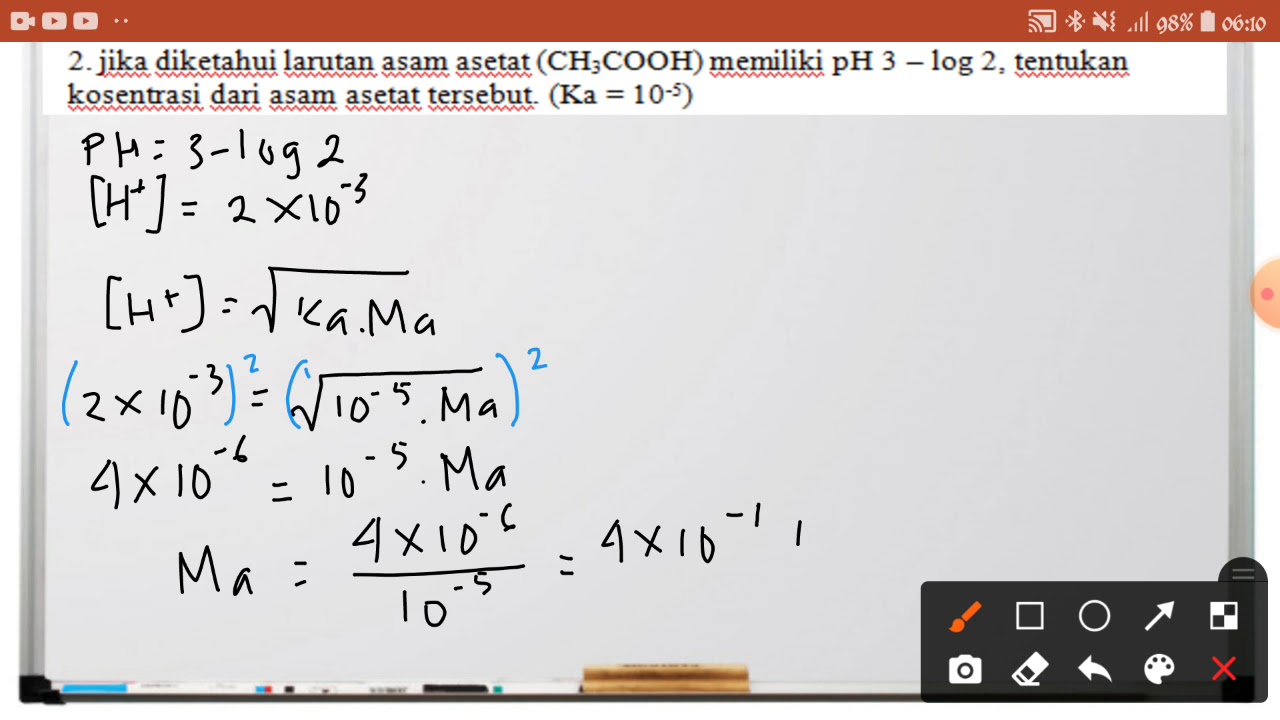
Teori Asam Basa Lewis.. Contoh Soal Asam Basa. Soal 1. Diberikan larutan yang memiliki pH 9. Apakah larutan tersebut bersifat asam, netral, atau basa? Jelaskan! Jawaban: Larutan dengan pH 9 bersifat basa. Skala pH berkisar dari 0 hingga 14, dan nilai pH di atas 7 menunjukkan sifat basa. Dalam hal ini, nilai pH 9 menunjukkan tingkat basa yang.
Get Contoh Soal Asam Basa Menurut Arrhenius Gif
Pembahasan : Menurut Lewis: • Asam: zat/senyawa yang dapat menerima pasangan elektron bebas dari zat/senyawa lain. • Basa: zat/senyawa yang dapat mendonorkan pasangan elektron bebas dari zat/senyawa lain. Jika reaksi diatas digambarkan dengan rumus Lewis, maka senyawa SO3 akan bertindak sebagai asam lewis: 2.
Contoh Soal Asam Basa Kimia SMA Kelas XI IPA YouTube
Video ini berisi tentang bagaimana cara menentukan Asam dan Basa berdasarkan teori asam basa Lewis. Ini adalah materi kimia kelas 11 IPA semester 2. Mohon ba.

latihan soal UN Asam basa brondsted Lowry kimia SMA YouTube
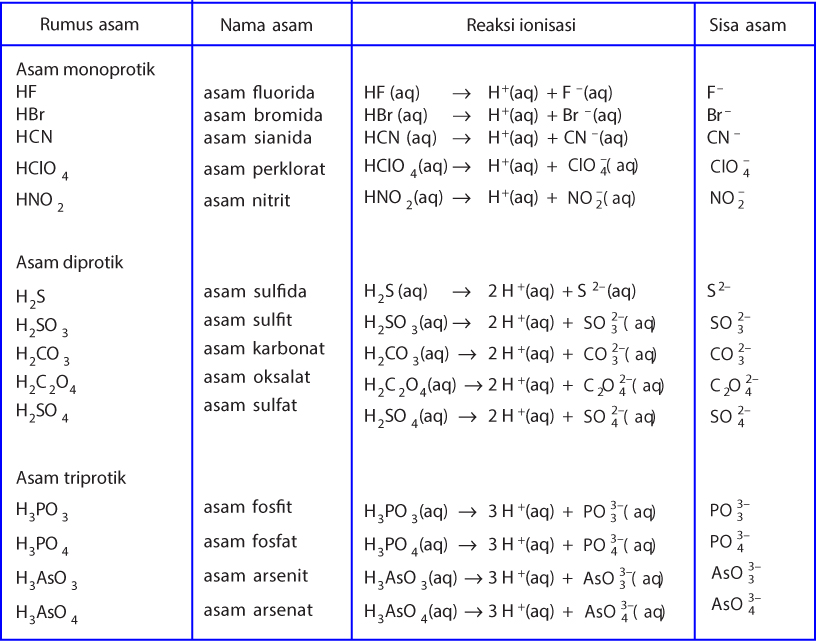
Baca Juga : 45+ Soal Asam Basa Pilihan Ganda dan Jawaban serta [+Pembahasan] 1. Pengertian Asam Basa. Asam dalam pelajaran kimia adalah senyawa kimia yang bila dilarutkan dalam air akan menghasilkan larutan dengan pH lebih kecil dari 7. Dalam definisi modern, asam adalah suatu zat yang dapat memberi proton (ion H +) kepada zat lain (yang disebut basa), atau dapat menerima pasangan elektron.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
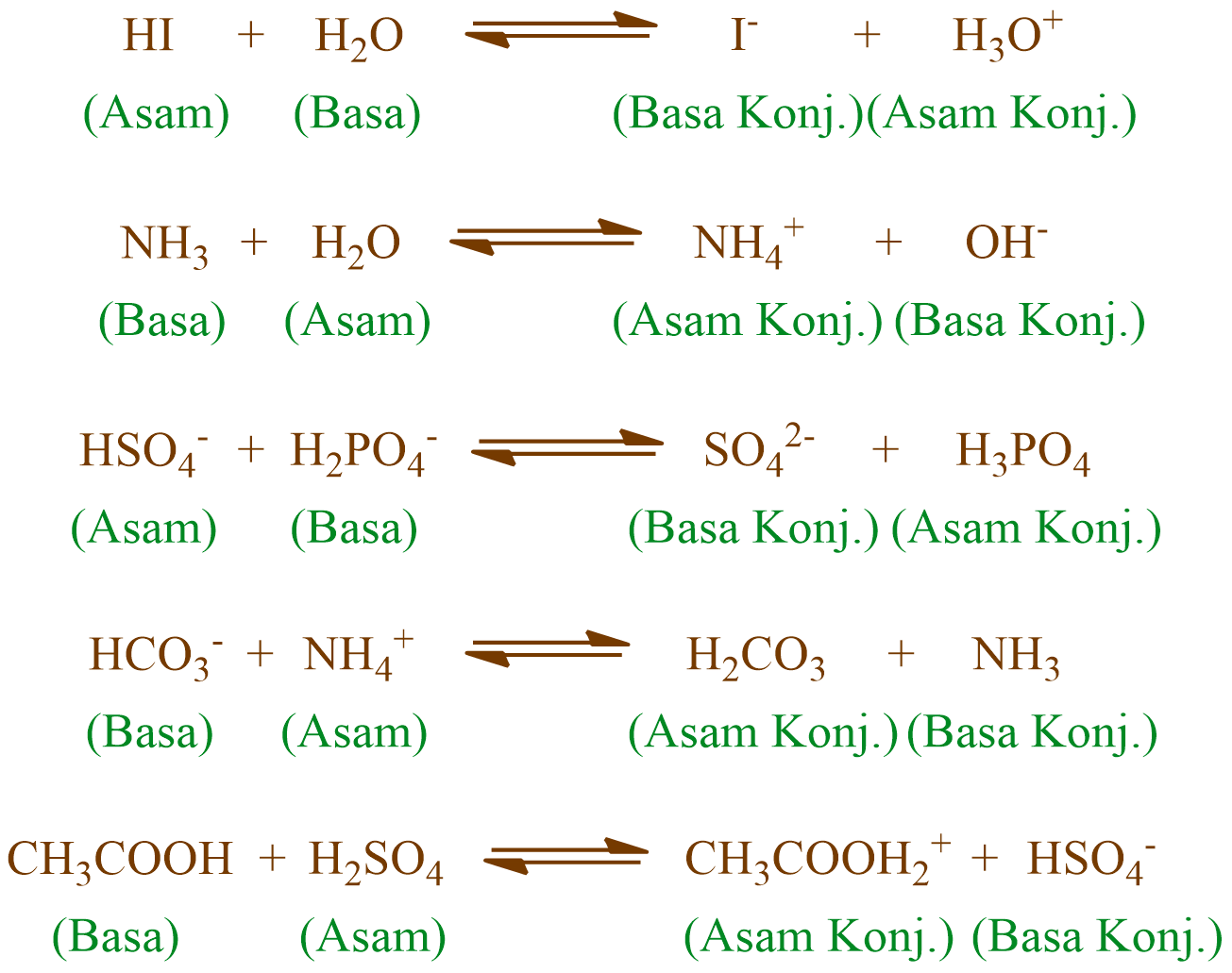
PEMBAHASAN : Pasangan asam- basa konjugasi adalah teori yang di cetuskan oleh Bronsted-Lowry. Dimana asam adalah zat yang memberikan/donor proton(H +) sehingga di akhir akan berkurang 1 H +.Sedangkan basa adalah penerima/akseptor proton(H +) sehingga di akhir akan bertambah 1H +.Jika dilihat dari reaksinya:

21+ Contoh Soal Menghitung Asam Basa Valeria Ashley
Teori asam-basa Brønsted-Lowry. Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923.. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Suatu asam atau basa disebut kuat jika terurai sempurna (atau mendekati sempurna) di dalam air, kekuatan ini disebut juga dengan kekuatan ionisasi. Contoh asam kuat adalah: HCl, HBr, H 2 SO 4, HNO 3, HI, HIO4, dan HbrO4.Untuk basa kuat contohnya adalah: NAOH (natrium hidroksida), KOH (kalium hidroksida), Ba(OH) 2 dan juga yang berasal dari golongan alkali (golongan IA) seperti Na dan K, dan.

LENGKAP ‼️ Cara Mudah Menentukan Pasangan Asam Basa Konjugasi TeoriAsamBasa AsamBasaKonjugasi
Soal 2: Apa perbedaan antara teori asam-basa Arrhenius dan teori asam-basa Brønsted-Lowry? Pembahasan: Teori Arrhenius hanya berlaku untuk asam dan basa yang larut dalam air, sementara teori Brønsted-Lowry lebih umum dan berlaku untuk asam dan basa dalam larutan lainnya. Menurut Brønsted-Lowry, asam adalah zat yang dapat mendonasikan proton.