
Soal Diketahui persamaan reaksi asam basa BronstedLowry berikut {[NH_(3)+H2O⇌NH_(4)^(+)+OH]
Assalamu'alaikum warahmatullahi wabarakatuh. Hai, semua! Selamat datang di channel Cerdas Kimia. Video berisi penjelasan teori Asam Basa 1. Arrhenius 2. Bron.

Konsep Mudah Belajar Teori Asam Basa BronstedLowry Kimia SMA YouTube
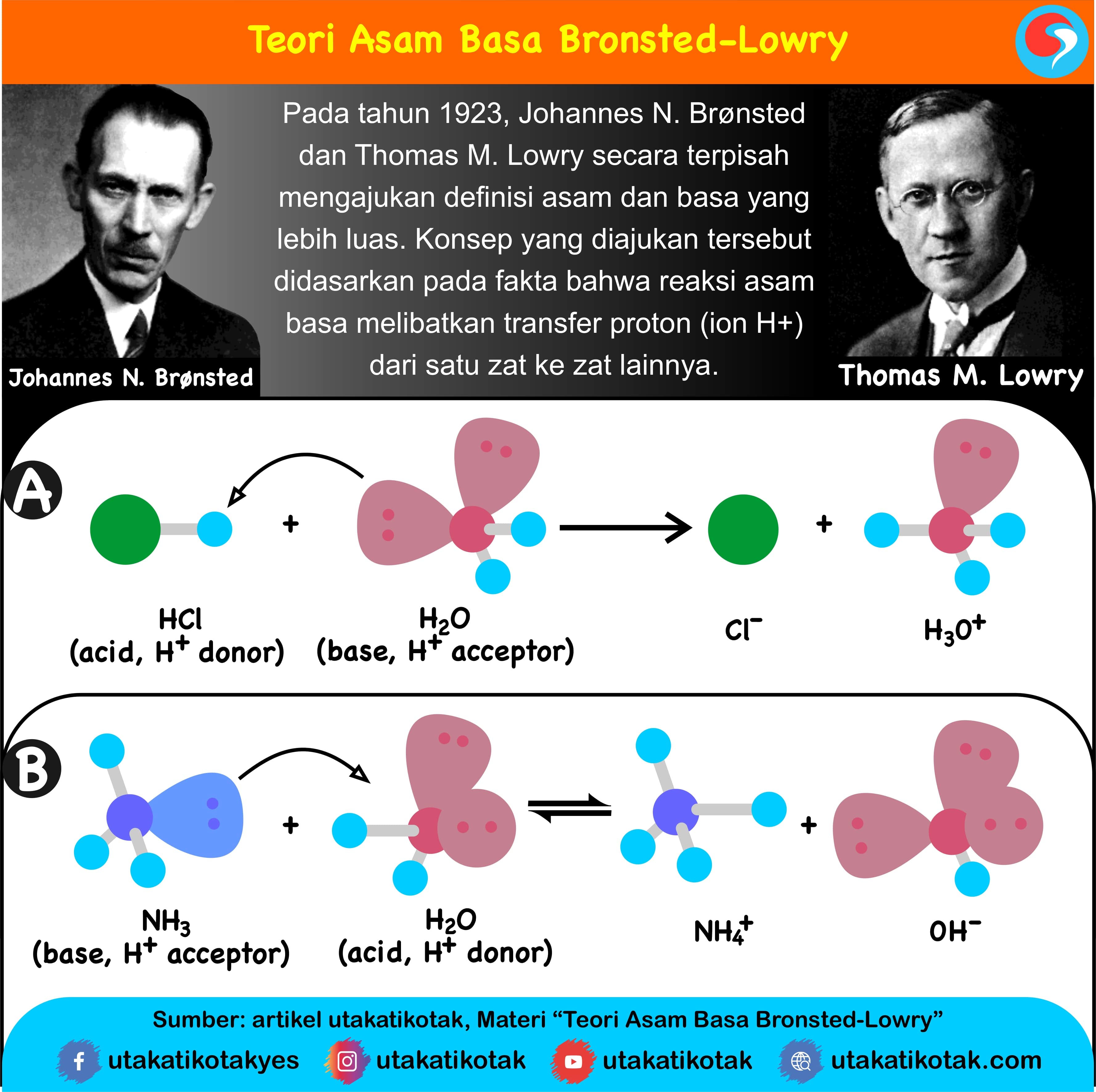
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

Contoh Soal Asam Basa Bronsted Lowry Ruang Ilmu
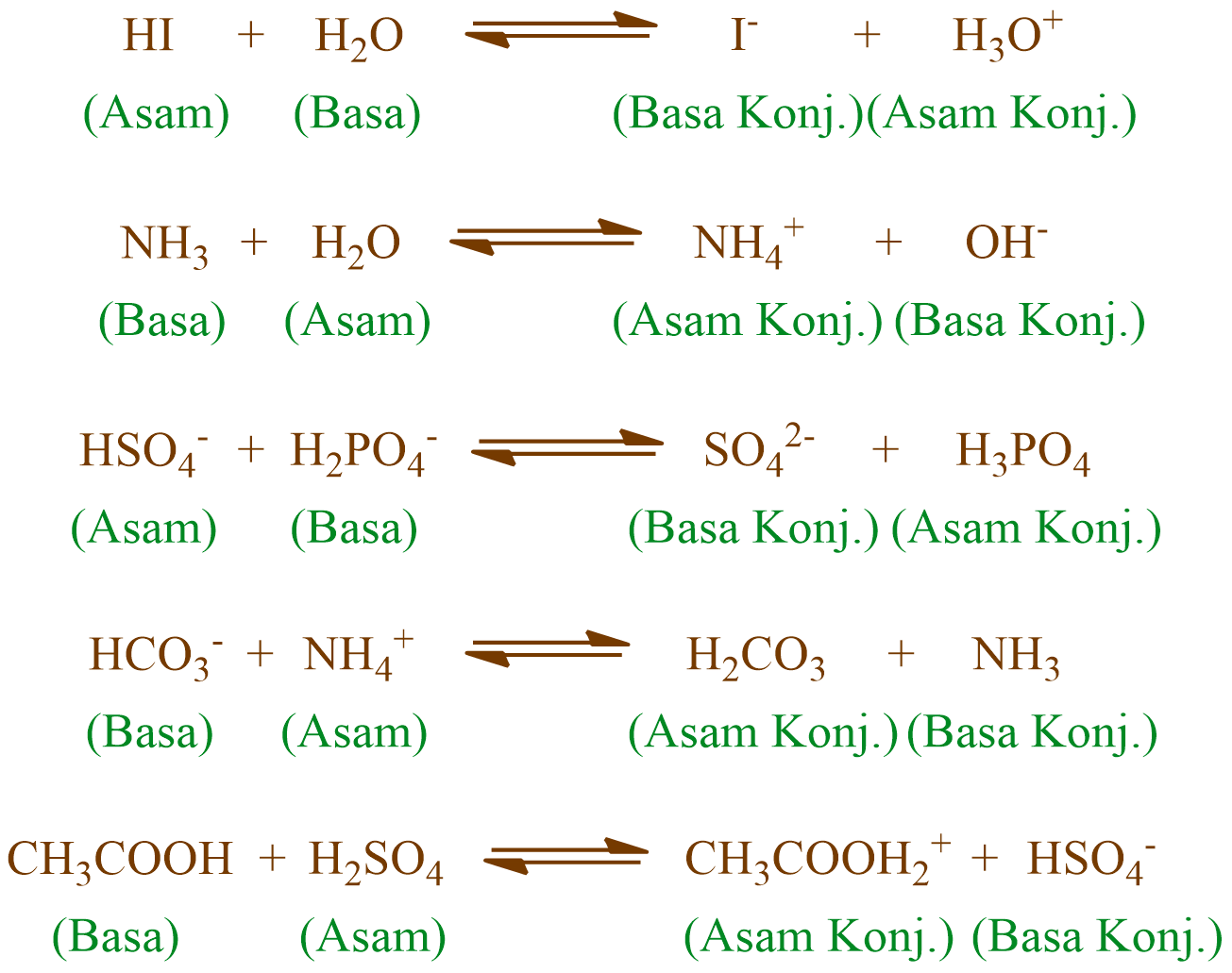
Asam dan Basa Konjugasi - RumusKimia.net berikut akan berbagi penjelasan tentang Asam dan Basa Konjugasi.. Kimia KELAS 12; ×. Beranda › Kimia SMA Kelas 11. Asam dan Basa Konjugasi dengan Contoh Soal. Pengertian Asam dan Basa Menurut Bronsted-Lowry. Kekuatan Asam Kuat dan Asam Lemah. Pasangan asam-basa setelah terjadi serah-terima.

Soal Jelaskan perbedaan konsep asam basa Arrhenius, BronstedLowry, dan Lewis!
Teori asam-basa Brønsted-Lowry. Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923.. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation.

Cara Mencari Pasangan Asam Basa Menurut Teori Bronsted Lowry AsamBasa YouTube
Basa = penerima H+. Reaksi kimia yang bisa dijadikan contoh berdasarkan teori Bronsted-Lowry misalnya pada asam klorida (HCL) dan air (H2O) berikut ini: HCl + H2O ⇌ H3O+ + Cl-. Penjelasannya seperti mengutip pada emodul Kemdikbud: HCL bersifat asam karena itu ia mendonorkan ion H+ nya kepada H20. H20 bersifat basa karena ia menerima donor H+.

Asam Basa Bronsted Lowry Bagian 3 (Asam Basa Konjugasi) Materi Asam Basa Kimia SMA Pojan
Soal nomor 43 SBMPTN 2018 ini menguji pemahaman tentang konsep asam-basa konjugasi (konsep asam-basa Bronsted-Lowry) serta konsep asam-basa Lewis. Asam Brownsted-Lowry adalah zat yang mampu mendonorkan proton (H +) kepada zat atau spesi lain, basa Bronsted-Lowry adalah zat yang menerima proton dari zat lain.

SOLVED pasangan asam basa Brinsted lowry secara berurutan 6 Diketahui persamaan reaksi asam
Oleh sebab itu timbullah gagasan baru mengenai asam-basa. 3. Teori Bronsted-Lowry. Muncul konsep asam basa menurut para ahli lain pada 1923, J.N Bronsted dari Denmark dan T.M Lowry dari Inggris secara terpisah dalam waktu yang bersamaan mengajukan konsep yang serupa, yakni: Asam adalah spesi yang dapat memberi proton (donor proton).

Contoh Soal Asam Basa Bronsted Lowry Ruang Ilmu
Pembahasan : Menurut Lewis: • Asam: zat/senyawa yang dapat menerima pasangan elektron bebas dari zat/senyawa lain. • Basa: zat/senyawa yang dapat mendonorkan pasangan elektron bebas dari zat/senyawa lain. Jika reaksi diatas digambarkan dengan rumus Lewis, maka senyawa SO3 akan bertindak sebagai asam lewis: 2.
Video belajar Soal Penentuan Asam dan Basa Menurut BronstedLowry Kimia untuk Kelas 11
Di dalam video ini, ko Ben akan membahas materi dan menjelaskan tentang soal soal yang biasanya diberikan dalam Kimia bab Larutan Asam Basa dengan detail. Ja.

latihan soal UN Asam basa brondsted Lowry kimia SMA YouTube
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted-Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H +; dan (2) basa Brønsted-Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H +.. Kelebihan definisi oleh Brønsted-Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam-basa dalam fase gas, padat.

Teori Asam Basa Bronsted Lowry Riset
1 - 15 Contoh Soal Asam Basa dan Jawaban. 1. Menurut teori asam-basa Bronsted-Lowry, asam didefinisikan sebagai zat yang . . . . a. Meningkatkan [H +] bila dimasukkan kedalam H 2 O. b. Menurunkan [H +] bila dimaasukkan kedalam H 2 O. d. Menerima 1 H + dari pasangan reaksinya.
Teori Asam dan Basa Menurut BronstedLowry
Sedangkan, HI dan KCl bukan merupakan reaksi asam basa, melainkan asam dan garam. Sehingga, nggak akan menghasilkan garam dan H2O. Contoh Soal 2. Definisi asam basa menurut Bronsted-Lowry yang tepat adalah.. a. Basa merupakan sifat dari senyawa yang dapat menghasilkan ion OH- dalam air. b.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
50. Rangkuman 1 Teori Asam-Basa Bronsted-Lowry. Rangkuman 2 Teori Asam-Basa Bronsted-Lowry. Rangkuman 3 Teori Asam-Basa Bronsted-Lowry. Kuis Akhir Teori Asam-Basa Bronsted-Lowry. 675. 300. Materi pelajaran Kimia untuk SMA Kelas 11 IPA bab Teori dan Karakteristik Asam-Basa ⚡️ dengan Teori Asam-Basa Bronsted-Lowry, bikin belajar mu makin seru.

Diketahui persamaan reaksi asam basa BronstedLowry berik...
Asam Basa menurut Bronsted-Lowry Asam : Pemberi/donor proton (H +) → berkurang di akhir 1 H + Basa : Penerima/akseptor proton (H +) → bertambah di akhir 1 H + Perubahan dari asam menjadi basa konjugasi yaitu akan mengalami pengurangan sebanyak 1 H + CH 3 OH dan CH 3 O -: Merupakan pasangan asam-basa konjugasi karena selisih 1 H +

Contoh Soal Dan Jawaban Asam Basa Konjugasi Jawaban Buku
Materi pelajaran Kimia untuk Kelas 11 Kurikulum Merdeka bab Asam-Basa ⚡️ dengan Teori Asam-Basa Bronsted-Lowry, bikin belajar mu makin seru dengan video belajar beraminasi dari Ruangbelajar.

Teori Asam Basa
2. Pada reaksi : NH3 + H2O ↔ NH4 + + OH -, pasangan H 2 O dan NH 3 adalah pasangan asam basa konjugasi. SEBAB . Menurut Bronsted-Lowry, asam adalah akseptor pasangan elektron bebas. Pembahasan : *Pengertian asam basa menurut Bronsted Lowry adalah : asam adalah donor proton sedangkan basa adalah akseptor proton