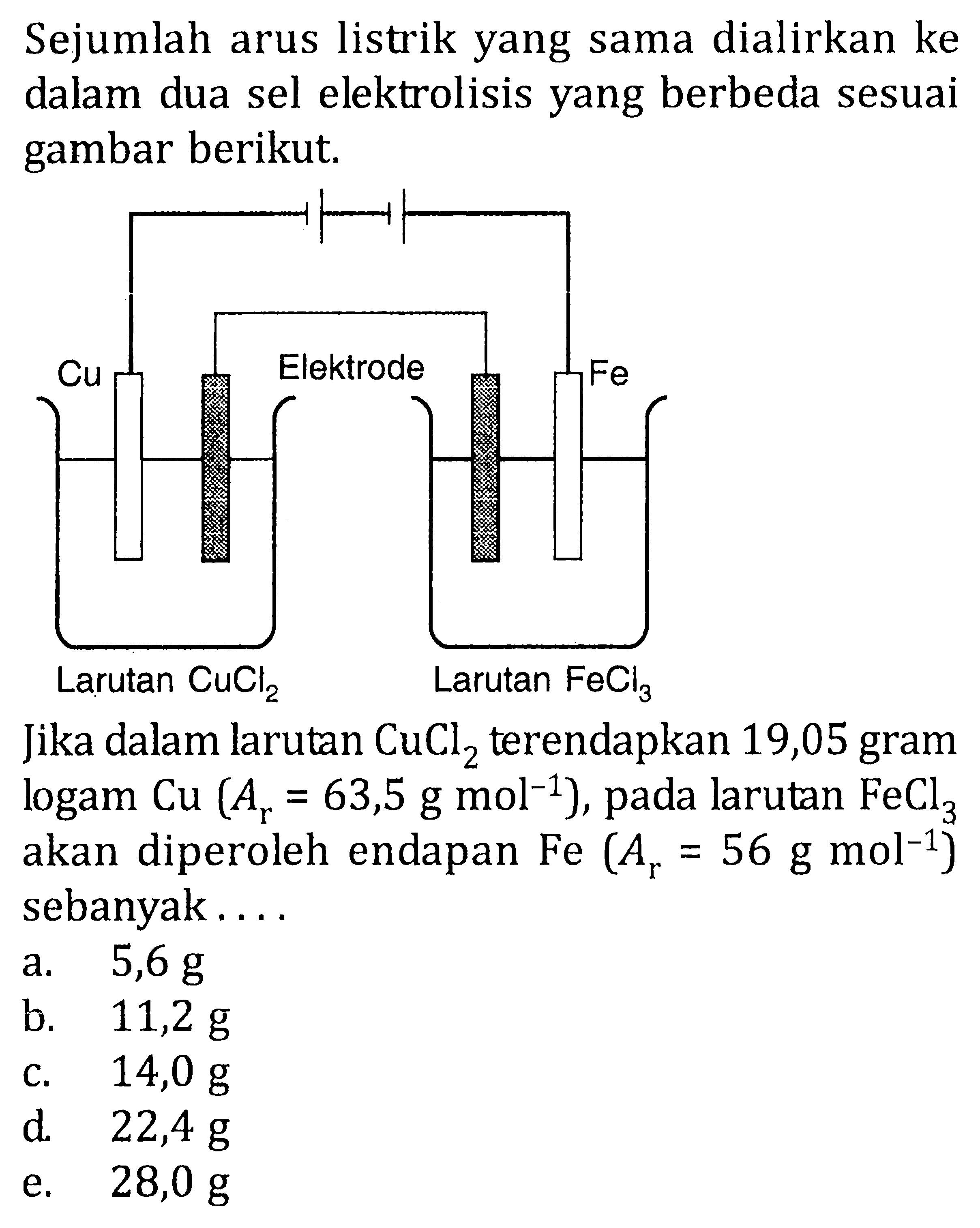
Dalam 100 mL larutan Pb(NO_(3))_(2) 1 M dialurkan aru...
elek-trolisasi larutan NaCl dengan jumlah listrik 2 Faraday, maka jumlah HClO yang terjadi adalah.. mol (A) 2 (B) 1 (C) 0,5 (D) 0,2 (E) 0,1 13. Sebanyak 250 mL larutan NaCl 0,01 M di-elektrolisis dengan menggunakan elektrode karbon. pH larutan yang terjadi di sekitar katode, adalah..

Sebanyak 50 ml larutan HCl 0,1 M dicampurkan dengan 50 ml larutan NH3 0,3 M ( Kb = 2 x 105
Elektrolisis Larutan NaCl dielektrolisis dengan elektrode grafit (inert) 2NaCl. Larutan NiSO 4 0,05 M dielektrolisis dengan elektrode grafit. Arus listrik yang digunakan 0,5 A dan di katode diendapkan logam nikel dengan massa 11,6 gram (Ar Ni = 58). H = 1) pH larutan setelah elektrolisis jika volume larutan 500 mL. PEMBAHASAN : Soal No.11.

Hitung volume larutan HCl 0,1 M yang ditambahkan ke dalam...
Karena massa jenis larutan = 1,01 gram/mL, maka 1 mL larutan = 1,01 gram massanya. HCOOH yang terdapat dalam larutan = 4,6 x 1,01 = 0,0464 gram. 100. Molaritas = 0,0464 x 1000 = 1,01 M. 46 1 . 7. Sebanyak 23,4 gram NaCl (Mr = 58,5) dilarutkan dalam air sampai volumenya 500 mL. Besarnya molaritas larutan adalah… Pembahasan dan jawaban:

Sebanyak 250 mL larutan CuCl_(2) 2 M dielektrolisis d...
Hai coffee n pada soal ini diketahui sebanyak 2 liter larutan NaCl dielektrolisis menggunakan elektrode karbon selama 2 jam. Jika muatan listrik yang digunakan sebesar 0,1 Faraday pH larutan setelah elektrolisis adalah NaCl akan menjadi 6 + + CL Min A berdasarkan aturan elektrolisis di katoda kation golongan 1A seperti n a plus yang potensial reduksi selnya lebih rendah dari penguraian H2O.

Sebanyak 2 gram cuplikan NaOH dilarutkan dalam 250 mL air...
Sebanyak 100 mL larutan AgNO 3 0,001 M dimasukkan ke dalam 100 mL larutan NaCl 0,01 M. Jika diketahui K sp AgCl = 1 , 6 × 1 0 − 10 , prediksilah apakah terbentuk endapan?. Gas HCl murni 12 mL dan 18 mL gas NH 3 murni dilarutkan ke dalam 250 mL air hingga seluruh gas larut dan volume air tidak berubah. Tekanan gas-gas 76 cmHg dan t = 27 0.
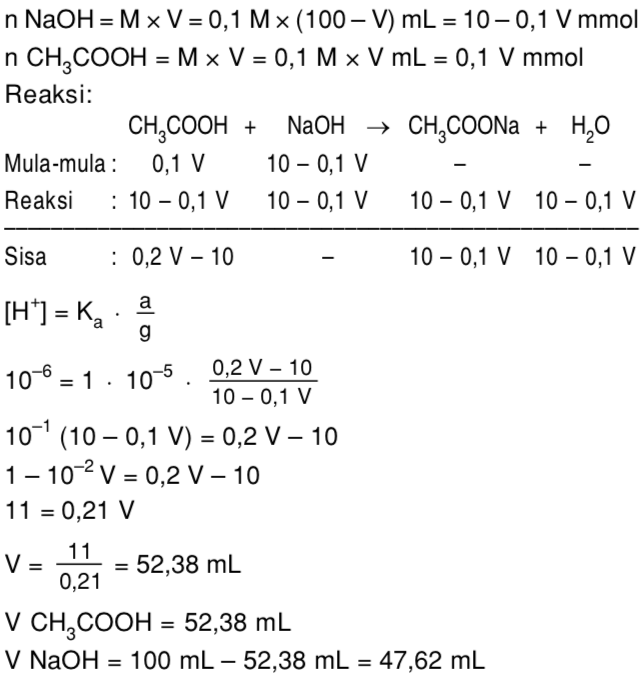
Larutan NaOH 0,1 M dicamour dengan CH3COOH 0,1 M membentuk 100 mL larutan penyangga Mas Soal
NaCl 0,1 m. BaCl₂ 0,1 m. C₂H₆O₂ 0,1 m. CH₃COOH 0,1 m. C₆H₁₂O₆ 0,1 m. 4. Multiple Choice. Edit.. Al₂(SO₄)₃ 0,01 M. NaCl 0,03 M. FeSO₄ 0,03M. Pb(NO₃)₂ 0,02 M. 8. Multiple Choice. Edit. 3 minutes. 1 pt.. Sebanyak 2 liter larutan NaNO₃ dielektrolisis selama 2 jam. Jika arus listrik yang digunakan sebanyak 2 A.

Sebanyak 100 mL larutan NaCl 0,2 M ditambahkan ke dal...
Bila 0,0965 ampere dilewatkan melalui 50 ml larutan NaCl 0,1 M selama 1.000 detik, maka konsentrasi ion OH-dalam larutan adalah . 0,05 M. 0,01 M. 0,02 M . 0,10 M. 0,30 M. 30. Multiple Choice. 15 minutes. 1 pt. Larutan NaCl sebanyak 5 liter yang dielektrolisis dengan arus listrik 24.125 coulomb. Harga pH larutan yang terjadi adalah . 2 - log 5.

Larutan NaCl yang volume 1 liter dielektrolisis selama 2
Reaksi elektrolisis di katoda dan anoda untuk larutan NaCl adalah sebagai berikut. Reaksi di katoda akan mempengaruhi pH larutan karena menghasilkan ion .. Larutan asam sulfat 0,1 M dielektrolisis dengan elektrode karbon pada sebuah pipa U selama 16 menit sehingga menghasilkan 2,24 liter gas (STP) pada anode..

Sebanyak 100 mL larutan H2SO4 0,1 M mempunyai pH
Contoh : Membuat larutan NaOH 0,1 M sebanyak 1 liter (Mr NaOH = 40 gr/mol ). Maka harus menghitung dulu berapa gram NaOH yang dibutuhkan. Caranya dengan mengunakan rumus molaritas : M = gr/Mr x 1000/V. 0,1 M = gr/40 x 1000/1000ml. gr = 4 gram. Maka NaOH yang dibutuhkan untuk membuat NaOH 0,1 M yaitu 4 gram.

Perhatikan diagram PT air, larutan urea 0,1 m dan NaC...
Sebanyak 50 mL larutan HCl 0,1 M direaksikan dengan 20 mL larutan NaOH 0,1 M. pH larutan tersebut adalah.. pH Asam Kuat, Basa Kuat, Asam Lemah, dan Basa Lemah; Asam dan Basa; Kimia Fisik dan Analisis;. Sebanyak 100 mL larutan NH3 0,1M mempunyai pH sama denga. Tonton video. Tentukan pH dan pOH larutan, jika 17,1 gram Ba(OH)2 dilar.

Larutan Pb(NO3)2 0,1 M sebanyak 150 ml dicampurkan de...
Reaksi Redoks dan Sel Elektrokimia. Sel Elektrolisis. Sebanyak 250 mL larutan CuCl_ (2) 2 M dielektrolisis dengan arus 5 A . Waktu yang diperlukan untuk mengendapkan semua logam tembaga adalah.. (Ar: Cu=63,5 g mol^ (-1) dan .Cl=35,5 g mol^ (-1) ; F=96.500 C mol^ (-1)) a. (67,25 x 96.500 x 5)/ (63,5 x 2) d. (67,25 x 63,5)/ (96.500 x 2 x 5) b.

Soal Sebanyak 2 L larutan NaCl dielektrolisis menggunakan elektrode karbon selama 2 jam. Jika m
Sebanyak 250 Ml Larutan Nacl 0 01 M Dielektrolisis - 250 ml larutan NaCl 0,01 M dielektrolisis dengan elektroda C (karbon). Berapa pH larutan di sekitar katoda? 250 ml larutan NaCl 0,01 M dielektrolisis dengan elektroda C (karbon). PH larutan di sekitar katoda adalah 12. Contents1 Sebanyak 250 Ml Larutan Nacl 0 01 M Dielektrolisis1.1 […]

Perbedaan Kandungan Nacl 0,9 Untuk Infus Dan Untuk Keperluan Lab Tanya Alodokter
Mari simak pembahasan soal UAS sel elektrolisis dibawah ini yang telah dirangkum dan diringkas dengan cara yang mudah: 1. Larutan krom (III) klorida dielektrolisis dengan arus searah dngan kuat arus sebesar 10 ampere. Jika pada katoda terjadi endapan logam krom (Ar Cr=52) sebesar 20 gram, tentukan waktu yang diperlukan untuk proses elektrolisis.

Percobaan titrasi antara 10 mL larutan H2SO4 dengan NaOH
Kesetimbangan Larutan (Ksp) Pengaruh Ion Senama terhadap Kelarutan. Sebanyak 50 mL larutan NaCl 0,3 M dicampur dengan 50 mL larutan AgNO3 0,1 M . Tentukan konsentrasi ion Cl^- dan ion Ag^+ dalam campuran tersebut. (Ksp AgCl=1 x 10^-10) Pengaruh Ion Senama terhadap Kelarutan. Kesetimbangan Larutan (Ksp) Kimia Fisik dan Analisis.

Sebanyak 50 mL larutan HCl 0,1 M ditetesi dengan larutan...
Pertanyaan. Sebanyak 1 liter larutan CrCl3 1,0 M dielektrolisis dengan arus 6 A. Waktu yang diperlukan untuk mengendapkan semua logam kromium (Ar = 52 dan 1 F = 96.500 C. mol−1) adalah. . 289.500 detik.

Jika larutan Na2SO4 0,1 M dielektrolisis menggunakan elektrode karbon, maka tuliskan reaksi yang
1. jika kamu mencampurkan 150 mL larutan NaCl 0,2 M dan 250 mL larutan NaCl 0,6 M, kemolaran NaCl setelah dicampurkan adalah; 2. Jika kamu mencampurkan 150 mL larutan NaCL 0,2 M dan 250 mL larutan NaCL 0,6 M. Kemolaran NaCL setelah dicampurkan adalah; 3. sebanyak 250 mL larutan Nacl 0.01 M dielektrolisis dg menggunakan elektrode C (karbon).