
prediksi un kmia 2018 , paket A pembahasan no 15, menentukan konstanta laju reaksi YouTube
Konstanta laju reaksi Dalam kinetika kimia suatu konstanta laju reaksi atau koefisien laju reaksi, k, mengukur (mengkuantifikasi) laju dari suatu reaksi kimia. [1] Bagi suatu reaksi antara reaktan A dan B untuk menghasilkan produk C a A + b B → c C laju reaksinya terkadang memiliki persamaan :

WANIBESAK Laju Reaksi, Koefisien Reaksi dan Persamaan Laju Reaksi
Laju reaksi adalah perubahan konsentrasi dari reaktan ataupun produk per satu satuan waktu. Untuk reaksi dengan reaktan A dan B menghasilkan produk C dan D seperti pada rumus persamaan reaksi berikut, seiring waktu jumlah molekul reaktan A dan B akan berkurang dan jumlah molekul produk C dan D akan bertambah, dan rumus laju reaksi (v) yaitu:
Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11
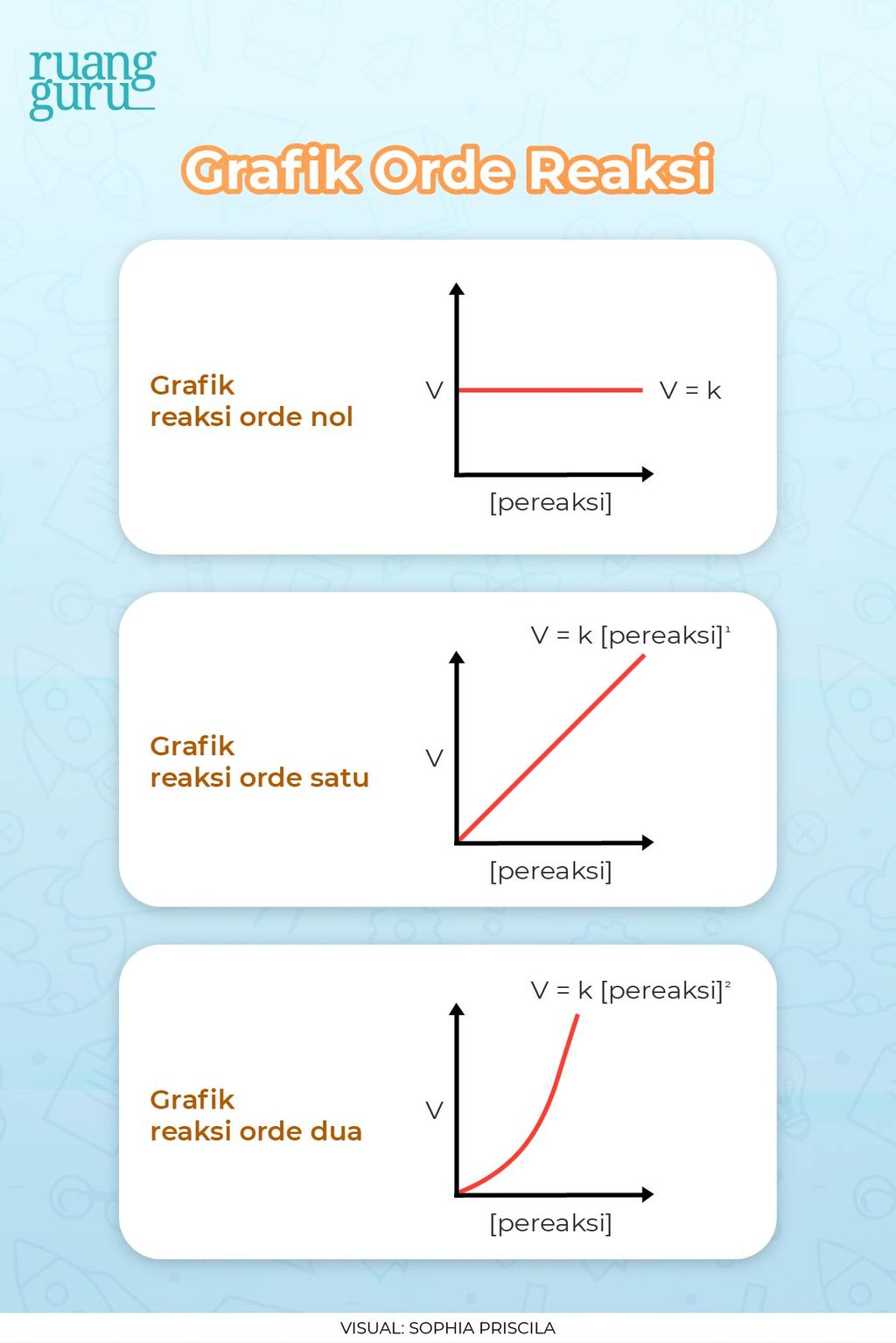
Suatu data eksperimental digunakan dalam penentuan laju suatu reaksi dimana hukum laju dan konstanta laju reaksi ini diperoleh dari penerapan hukum aksi massa. Hukum laju ini mengatur perhitungan sederhana untuk reaksi dengan orde 0, orde 1 dan orde 2:
Video belajar Soal Menentukan Orde dan Persamaan Laju Reaksi dengan 1 Reaktan Kimia untuk Kelas 11
Katalis Katalis dapat mempengaruhi laju reaksi. Katalis yang dapat mempercepat laju reaksi disebut katalis positif atau dikenal dengan nama katalisator. Sedangkan katalis yang memperlambat laju reaksi disebut katalis negatif atau dikenal dengan nama inhibitor. B. Persamaan Laju Reaksi

(PDF) Data Fitting untuk menentukan orde dan konstanta laju reaksi · Rumus Umum Satuan k. Metode
Konstanta laju adalah faktor proporsionalitas dalam hukum laju kinetika kimia yang menghubungkan konsentrasi molar reaktan dengan laju reaksi. Ini juga dikenal sebagai konstanta laju reaksi atau koefisien laju reaksi dan ditunjukkan dalam persamaan dengan huruf k . Takeaways Utama: Nilai Konstan

Hukum Laju Reaksi
Cuaca & Iklim Diperbarui pada 16 April 2019 Pada tahun 1889, Svante Arrhenius merumuskan persamaan Arrhenius, yang menghubungkan laju reaksi dengan suhu . Sebuah generalisasi luas dari persamaan Arrhenius adalah mengatakan bahwa laju reaksi untuk banyak reaksi kimia berlipat ganda untuk setiap kenaikan 10 derajat Celcius atau Kelvin.
Video belajar Soal Menentukan Satuan Konstanta Laju Reaksi Suatu Reaksi dari Persamaan Laju
(Reaktan) (Produk) Di mana, v= laju reaksi (mol/L/s); = perubahan mol; = perubahan waktu atau, Di mana, v= Laju reaksi (mol/L/s) ; k= konstanta laju reaksi; n= orde reaksi zat B; m= orde reaksi zat A. Secara logika, pada saat bereaksi, zat reaktan pasti makin berkurang, dan zat produk pasti bertambah bukan?

Contoh Soal Laju Reaksi YouTube
From Wikipedia, the free encyclopedia Dalam kinetika kimia suatu konstanta laju reaksi atau koefisien laju reaksi, k, mengukur (mengkuantifikasi) laju dari suatu reaksi kimia. Bagi suatu reaksi antara reaktan A dan B untuk menghasilkan produk C a A + b B → c C laju reaksinya terkadang memiliki persamaan:

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI DARI TABEL PERCOBAAN YouTube
tirto.id - Laju reaksi adalah laju berkurangnya kosentrasi pereaksi atau laju bertambahnya konsentrasi hasil reaksi tiap satuan waktu. Secara sederhana, laju reaksi diartikan sebagai perubahan konsentrasi pereaksi (reaktan) atau reaksi (produk) persatuan waktu.

Satuan Tetapan Laju Reaksi K Untuk Reaksi Orde 2 Adalah
Laju reaksi adalah perubahan konsentrasi reaktan atau produk per satuan waktu. Besaran laju reaksi dilihat dari ukuran cepat lambatnya suatu reaksi kimia. Laju reaksi mempunyai satuan M/s (Molar per detik ). [1] Laju reaksi dilambangkan dengan v atau r.

PPT REAKSI PowerPoint Presentation, free download ID3346182
Secara matematik, rumus umum laju reaksimerupakan perubahan jumlah molar zat per satuan waktu, ditulis sebagai berikut: Di mana: v = laju reaksi (M/s) Δ[x] = perubahan konsentrasi molar zat (M) Δt = perubahan waktu (s). Konstanta Laju Reaksi. Konstanta laju reaksi (k)adalah tetapan yang harganya bergantung pada jenis pereaksi, suhu, dan.

[LAJU REAKSI] MENENTUKAN ORDE REAKSI JIKA DIKETAHUI SATUAN KONSTANTA REAKSI YouTube
Persamaan Laju Reaksi. Bila diketahui suatu reaksi: lA + mB → nC + oD. Maka persamaan lajunya dapat dinyatakan sebagai. v = k[A]x[B]y. dimana, k = tetapan jenis reaksi. x = orde (tingkat atau pangkat) reaksi terhadap pereaksi A. y = orde (tingkat atau pangkat) reaksi terhadap pereaksi B.

contoh soal laju reaksi kimia dan pembahasannya Perhitungan kimia
Laju reaksi mempunyai satuan konsentrasi dibagi waktu. Maka yang paling mudah untuk satuan laju reaksi adalah molar per detik (M/s). Konstanta Laju Reaksi. Pada suhu tetap, laju reaksi tergantung pada konsentrasi reaktan. Hubungan yang pasti antara konsentrasi dan laju reaksi ditentukan dengan mengukur laju reaksi dengan perbedaan konsentrasi.

Persamaan Laju Reaksi dan Orde Reaksi Laju Reaksi Kimia Kelas 11 YouTube
Konstanta k merupakan tetapan laju reaksi atau koefisien laju reaksi. Nilai koefisien k ini dapat bergantung pada kondisi seperti suhu, kekuatan ionik, luas permukaan dari suatu adsorben, atau iradiasi cahaya. Reaksi elementer

Cara Cepat menentukan Laju Reaksi Konsep Dasar tabel MTS YouTube
Simak uraian berikut. Molaritas sebagai Satuan Konsentrasi dalam Laju Reaksi Molaritas menyatakan jumlah mol zat dalam 1 L larutan, sehingga molaritas yang dinotasikan dengan M, dan dirumuskan sebagai berikut. M = n/V Keterangan : n = jumlah mol dalam satuan mol atau mmol V = volume dalam satuan L atau mL Manfaat Laju Reaksi

Laju Reaksi Kimia Rumus Bit CDN
Laju reaksi merupakan perubahan konsentrasi dari reaktan atau produk terhadap waktu (satuan M/s). Beberapa reaksi yang terjadi di alam ada yang berlangsung sangat cepat atau sangat lambat. Contoh reaksi yang berlangsung sangat cepat yaitu reaksi fotosintesis dan reaksi berantai nuklir yang memerlukan rentang waktu 10 -12 s sampai 10 -16 s.