5 Tahapan Reaksi Kimia kabarmedia.github.io
Konsep mol didukung oleh adanya bilangan Avogadro yang ditemukan oleh fisikawan italia bernama Amadeo Avogadro. Bilangan Avogadro menyatakan bahwa dalam satu mol zat, terdapat partikel sejumlah 6,02214076x10^23. Baca juga: Pengertian dan Contoh Soal Fraksi Mol. Contohnya adalah 1 mol air mengandung 6,02214076x10^23 partikel air, sangat banyak.

Menghitung Volum Gas Pada Suhu dan Tekanan Tertentu YouTube
Jawab: a) Gas O2 adalah unsur diatomik dengan partikel berupa molekul unsur. b) Banyaknya mol O2 yang mengandung 1,505 × 1023 partikel dapat kita hitung dengan menggunakan rumus berikut. Jumlah partikel = mol × N. mol = Jumlah partikel/N. mol = 1,505 × 1023/6,02 × 1023. mol =1,505/6,02. mol = 0,25 mol.

Relative Atomic Mass, Here's an explanation, formula, and how to calculate it World Today News
Massa 1,5 mol C = 1,5 mol × 12 g mol-1 = 18 g. 3. Ar Fe = 56 sma, Jadi, massa molar Fe = 56 g mol-1. m = 9,3 × 1023 g. 4. Massa molar CO2 = 44 g mol-1. Jumlah molekul CO2 = 0,54× 1023 molekul. Demikianlah artikel tentang pengertian dan rumus massa molar (Mm), beserta contoh soal dan pembahasannya lengkap.

A gas known to be a mixture of propane (C3H8) and methane (CH4) is confined in a vessel at
Satu mol CH4 mengandung. . . . 668. 1. Jawaban terverifikasi. Iklan. Iklan. AA. Aldebaran A. 12 Desember 2021 15:14. Jawaban terverifikasi. 1 mol senyawa mengandung = 6,02 x 10²³ partikel berupa atom, ion, ataupun molekul. Jika dikaitkan dgn massa, maka massa CH4 = Mol x Mr = 1 mol x 16 g/mol = 16 g. Jadi 1 mol CH4 mengandung 16 g massa dan 6.

How many moles of oxygen are needed for the complete combustion of 3 moles of ch4 Brainly.in
Menurut Nana Sutresna dalam Kimia (2008) rumus molekul unsur ada dua, yaitu rumus molekul unsur diatomik dan poliatomik. 1. Rumus molekul diatomik. Rumus molekul diatomik digunakan untuk mengidentifikasi molekul yang terbentuk dari dua atom sejenis. Kebanyakan molekul diatomik berbentuk gas pada suhu ruang. 2.
Hubungan Mol dengan Jumlah Partikel dan Massa Zat cekrisna
Konsep Mol dan Hubungannya dengan Jumlah Partikel, Massa Molar, dan Volume Molar; Satu mol CH4 mengandung. Konsep Mol dan Hubungannya dengan Jumlah Partikel, Massa Molar, dan Volume Molar; Hukum-Hukum Dasar Kimia dan Stoikiometri; Kimia Fisik dan Analisis

Contoh Soal Fraksi Mol Dan Pembahasannya
Satu mol CH4 mengandung 6,02× 1023 molekul CH4. Sedangkan hubungan mol dengan massa adalah: mol = M rmassa 1 mol = 16 g/molmassa massa = 16 g. Satu mol CH4 berarti bahwa massa CH4 sama dengan Mr CH4, yaitu 16 gram yang terdiri atas 12 gram atom C dan 4 gram atom H. massa atom H = M r CH4jumlah atom H×Ar atom H ×16 gram massa atom H = 164×1.

2 mol ch4 molekülündeki toplam atom sayısı hangi işlemle bulunur
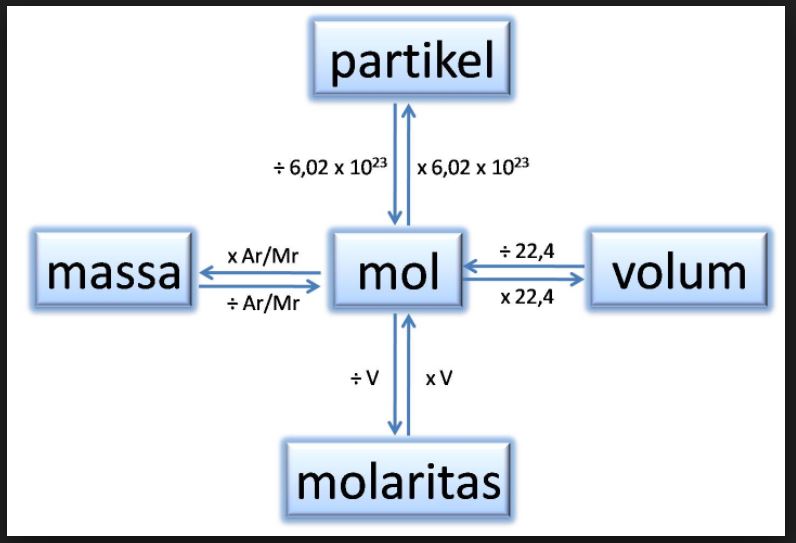
Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel zat itu sebanyak atom yang terdapat dalam 12,000 gram atom karbon - 12. Dalam satu mol suatu zat terdapat 6,022 x 1023 partikel. Di mana, nilai 6,022 x 10 23 partikel per mol disebut sebagai tetapan Avogadro, dengan. lambang L atau N. Konsep Mol - Massa (G) Konsep Mol - Volume

Molar Mass / Molecular Weight of CH4 (Methane) YouTube
Seperti soal sebelumnya, kita gunakan terlebih dahulu rumus mol namun terhadap volume gas STP. Selanjutnya kita bisa masukan ke dalam persamaan. Massa senyawa = Mr x Jumlah mol. 4,25 g = Mr x 0,125 mol. Mr = 34. Jadi, diketahui Mr dari 4,25 g gas dengan volume 2,8 L sebesar 34.

Ch4 Molar Mass
Hukum Avogadro menyatakan bahwa volume gas yang sama pada kondisi yang sama mengandung jumlah partikel yang sama, terlepas dari jenis gasnya. Ini berarti satu mol gas oksigen (O2) dan satu mol gas hidrogen (H2) pada kondisi yang sama memiliki volume yang sama. 2. Hukum Perbandingan Tetap. Massa molar CH4 = 12 (C) + 1 (H) x 4 = 16 gram/mol;

Using the following information calculate the heat of formation of CH4 . CH4(g) + 2 O2(g)→ CO2(g
Konsep mol Kimia ternyata enggak sesulit yang dibayangkan, lho. Simak penjabaran konsep, pengertian, dan latihan soalnya di sini, yuk.. Satu mol menunjukkan banyaknya partikel yang terkandung dalam suatu zat yang jumlahnya sama dengan jumlah partikel dalam 12 gram atom C-12.. Untuk 1 mol zat mengandung 6,02 × 10 23 partikel. Dengan.

Jumlah Mol Yang Terdapat Dalam 4 Gram Ch4 Adalah Ujian
Satu liter campuran gas pada suhu 100°C pada keadaan setimbang mengandung 0,0045 mol dinitrogen tetraoksida dan 0,03 mol nitrogen dioksida. Tuliskan rumus tetapan kesetimbangan gas tersebut. Hitung tetapan kesetimbangannya. Jawab: N 2 O 4 (g) ⇌ NO 2 (g) Persamaan di atas harus disetarakan dulu menjadi. N 2 O 4 (g) ⇌ 2NO 2 (g) a.

Fraksi Mol Dan Molalitas M Soal Dan Pembahasan Kimia Kelas 12 Riset
Beranda. Salah satu cara membuat metana adalah mereaksikan. Iklan. Pertanyaan. Salah satu cara membuat metana adalah mereaksikan karbon disulfida dengan gas hidrogen, dan K c pada 900 ∘C adalah 27,8. CS2(g)+4H2(g) ⇌ CH4(g)+2H2S(g) Pada kesetimbangan campuran reaksi dalam wadah 4,70 L mengandung 0,250 mol CS2, 1,10 mol H2, dan 0,45 mol.

Jumlah Mol Yang Terdapat Dalam 4 Gram Ch4 Adalah Ujian
Senyawa hidrokarbon seperti namanya, hidro dan karbon berarti merupakan senyawa yang tersusun dari atom hidrogen (H) dan atom karbon (C). Sehingga senyawa hidrokarbon memiliki rumus CxHy, dengan x dan y tergantung golongan hidrokarbon itu sendiri. Dilansir dari Chemistry Libretexts, karbon merupakan atom yang unik karena dapat berikatan satu.

Contoh Soal Dan Jawaban Tentang Hukum Avogadro
Satu mol didefinisikan sebagai jumlah zat suatu sistem yang mengandung "entitas elementer" (atom, molekul, ion, elektron) sebanyak atom-atom yang berada dalam 12 gram karbon-12. Jadi: 1 Mol besi mengandung sejumlah atom yang sama banyaknya dengan satu mol emas; 1 Mol benzena mengandung sejumlah molekul yang sama banyaknya dengan satu mol air;

Pembakaran satu mol gas metana mengikuti persamaan termok...
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Satu mol CH4 mengandung..