
Ppt Pembentukan Larutan Dan Konsentrasi Larutan Powerpoint Riset
Pengertian dan Rumus Penurunan Titik Beku Menurut Rananda Vinsiah dalam Fenomena Sifat Koligatif Larutan Kimia Kelas XII (2020, hlm. 19), titik beku merupakan kondisi ketika tekanan uap suatu cairan sama dengan tekanan padatannya. Pada kondisi seperti itu, cairan akan mulai membeku. Seandainya ada suatu zat terlarut yang dicampurkan ke pelarut murni, akan tercipta larutan baru.

Rumus Penurunan Titik Beku Panduan Lengkap dan Detail
Penurunan titik beku adalah selisih antara titik beku pelarut dengan titik beku larutan. Penurunan titik beku ini termasuk salah satu sifat koligatif larutan. Dalam perhitungan kimia, penurunan titik beku disimbolkan dengan ΔT f (f berasal dari kata freeze) atau ΔT b . Peristiwa penurunan titik beku ini sering diterapkan pada negara-negara.

Contoh Soal Titik Beku Larutan (Sifat Koligatif Larutan Elektrolit) YouTube
Rumus titik beku larutan merupakan salah satu konsep penting dalam kimia. Dalam artikel ini, kita akan menjelajahi secara mendalam tentang rumus titik beku larutan, termasuk bagaimana cara menghitungnya dan mengapa hal ini penting dalam analisis larutan. Dengan pemahaman yang baik tentang rumus ini, Anda akan dapat mengaplikasikannya dalam.
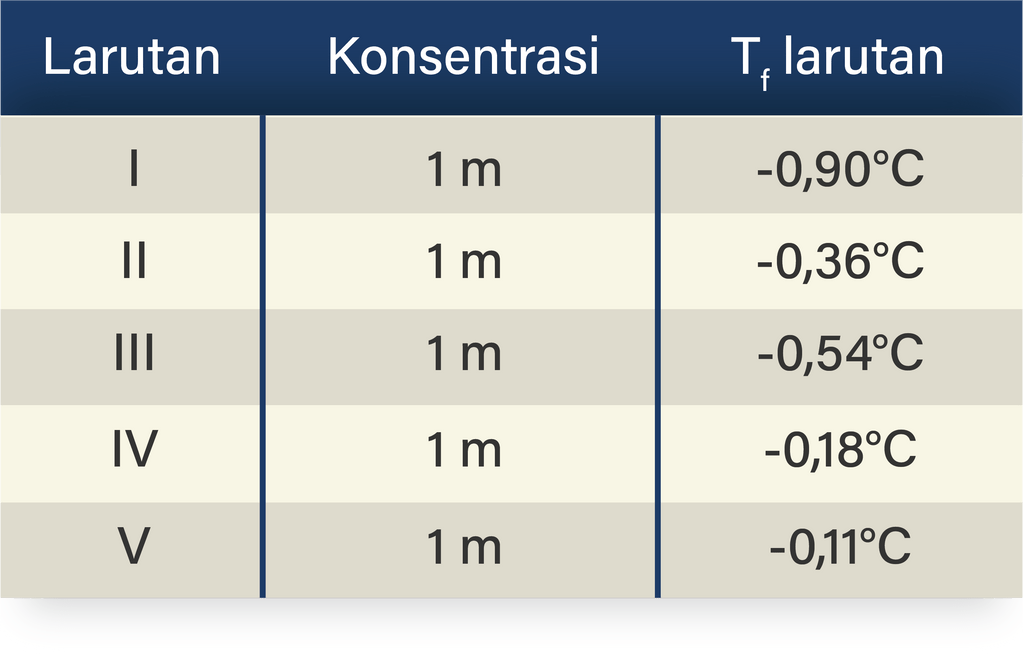
Berikut ini data titik beku beberapa larutan dalam...
Penurunan titik beku larutan elektrolit. Rumus penurunan titik beku larutan elektrolit sebagai berikut: ΔT f = K f. m . {1 + (n - 1) α} Keterangan: n = jumlah ion; α = derajat ionisasi; Contoh soal dan pembahasan. Contoh soal 1. Sebanyak 2,4 gram urea (Mr = 60) dilarutkan dalam 50 gram air. Jika Kf air = 1,86 °C/m, tentukanlah titik beku.
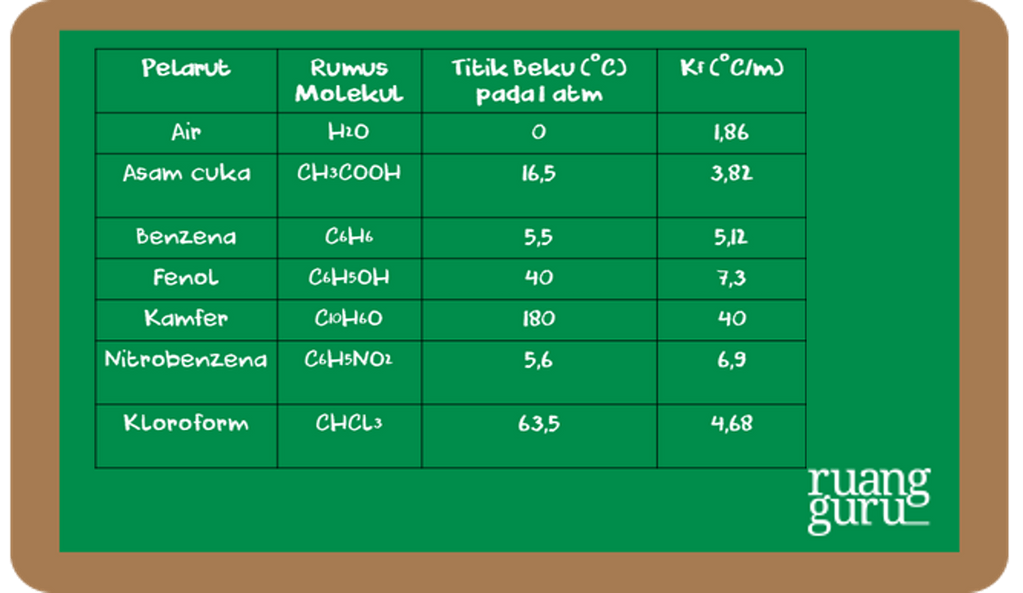
Mengetahui Proses Penurunan Titik Beku Kimia Kelas 12
Penurunan titik beku larutan bisa kamu cari dengan rumus ΔTf = m x Kf, dimana ΔTf adalah penurunan titik beku, m adalah molalitas larutan, dan Kf adalah tetapan penurunan titik beku molal. Kenaikan titik didih larutan selalu memiliki nilai yang lebih tinggi dari titik didih pelarut murninya. Hal ini disebabkan karena partikel dalam zat.

Menentukan Rumus Molekul Senyawa dari Penurunan Titik Beku YouTube
tentukan titik didih dan titik beku larutan yang mengandung 18 gram glukosa , Mr 180 dalam 500 gram air. jika kb dan kf diketahui. sifat koligatif larutan..

Rumus titik beku larutan
Artinya, penurunan titik beku adalah sifat koligatif larutan di mana titik bekunya lebih rendah daripada pelarut murni. Rumus penurunan titik beku. Besar penurunan titik beku didapat dari selisih antara titik beku pelarut dan titik beku larutan sebagai berikut: Dengan, ΔTf: penurunan titik beku Tf0: titik beku pelarut murni Tf: titik beku larutan

Contoh Soal Titik Beku Larutan (Sifat Koligatif Larutan Non Elektrolit) YouTube
Contoh Soal Penurunan Titik Beku - Membahas mengenai perhitungan suatu proses kimia terkait zat berbentuk larutan. Dimana reaksi penurunan titik beku tersebut terjadi pada saat suatu larutan saat ditambahkan senyawa lain. Jika dilihat dari sudut pandang ilmu kimia, larutan mempunyai berbagai sifat baik dalam bentuk sifat kimia ataupun sifat fisis.. Dimana salah satu materi sifat fisis.

Contoh Soal Perbandingan Penurunan Titik Beku (Sifat Koligatif Larutan Elektrolit) YouTube
Mengenal Rumus dan Contoh Soal Hukum Hess. ∆Tf = Tf (pelarut) - Tf (larutan) ∆Tf = m . Kf. Keterangan: ∆Tf = penurunan titik beku (freezing point depression) m = molalitas. Kf = tetapan penurunan titik beku (ºC kg/mol) Untuk mengaplikasikan rumus di atas, Anda bisa menyimak contoh soal di bawah ini agar meningkatkan pemahaman.

Penurunan Titik Beku
Dapatkan Modul, Rumus, & Soal Sifat Koligatif Larutan lengkap di Wardaya College.. Demikian pula pada penurunan titik beku larutan, tekanan uap larutan juga lebih rendah daripada tekanan uap pelarut murni. Sehingga agar larutan membeku, harus didinginkan ke suhu yang lebih rendah akibatnya titik beku larutan lebih rendah dari titik beku.

Kenaikan Titik Didih Larutan Pengertian Dan Rumus Materiipa Com My XXX Hot Girl
Titik beku larutan = 0 °C - 18,6 °C = -18,6 °C. Titik beku larutan 64 gram naftalena dalam 100 gram benzena adalah 2,91 °C. Jika titik beku benzena 5,46°C dan tetapan titik beku molal benzena 5,1 °C, maka tentukan massa molekul relatif naftalena! Jawab: ΔTf = m × Kf ΔTf = massa benzena/Mr x 1.000/p x Kf

Cara Menghitung Tetapan Penurunan Titik Beku Larutan (Kf) (UN Kimia 2018 No. 24) YouTube
ΔT f = kenaikan titik didih larutan T f = titik beku larutan T f o = titik beku pelarut murni m = molalitas K f = tetapan penurunan titik beku molal (o C kg mol-1) Contoh Soal. Sebanyak 0, 6 gram urea, CO(NH 2) 2 sobat larutkan ke dalam 40 gram air. Jika larutan tersebut kita anggap idela, tentukan berapa titik didih dan titik beku larutan.

Perhatikan diagram PT air, larutan urea 0,1 m dan NaC...
Ket: ΔT f = penurunan titik beku larutan (°C) m = molalitas (m) K f = tetapan penurunan titik beku molal (°C m-1) n = jumlah ion elektrolit α = derajat ionisasi/disosiasi. 3. Kenaikan Titik Didih (ΔT b). Sederhananya seperti ini. Saat zat pelarut (misalnya air) dipanaskan hingga menguap, partikel pelarut tersebut bergerak sangat cepat hingga berubah menjadi face gas.

Penurunan Titik Beku Larutan Definisi Dan Penyebabnya Reverasite
1. Titik Beku (Tf) Jadi begini , proses pembekuan itu terjadi ketika suatu zat telah mencapai titik beku. Titik beku ( Tf) akan tercapai apabila temperatur saat tekanan uap zat padat, sama dengan tekanan uap zat cair. Jika kalian mengetahui bahwa titik beku air sebesar 0ºC, itu artinya tekanan uap air dalam bentuk cair pada temperatur 0ºC.

Firstwisnu Media Kenaikan Titik Didih Dan Penurunan Titik Beku Larutan Reverasite
Rumus dan Perhitungan Penurunan Titik Beku. Perhatikan bahwa dalam kasus senyawa kovalen atau molekul non-elektrolit, nilai faktor van't Hoff (i) biasanya adalah 1, karena senyawa ini tidak mengionisasi dalam larutan.. Sebagai hasil dari penurunan titik beku, larutan non-elektrolit akan memiliki titik beku yang lebih rendah daripada titik.

Konsep Mudah Menentukan Titik Didih, Titik Beku Dan Tekanan Osmotik Larutan Elektrolit KIMIA
Untuk larutan elektrolit menggunakan rumus: Keterangan: ∆T f = Penurunan titik beku. K f = Tetapan penurunan titik beku molal. n = Jumlah mol zat terlarut. p = Massa pelarut. i = Faktor Van't Hoff. Dalam bidang thermodinamika konstanta titik beku ( K f ) lebih dikenal dengan istilah "Konstanta Kriokopik".