
Persamaan Laju Reaksi dan Orde Reaksi KIMIA KELAS 11 YouTube
Persamaan Laju Reaksi. Bila diketahui suatu reaksi: lA + mB → nC + oD. Maka persamaan lajunya dapat dinyatakan sebagai. v = k[A]x[B]y. dimana, k = tetapan jenis reaksi. x = orde (tingkat atau pangkat) reaksi terhadap pereaksi A. y = orde (tingkat atau pangkat) reaksi terhadap pereaksi B.

Rumus Laju Reaksi dan orde reaksi Kimia SMA YouTube
Tuliskan rumusan tetapan kesetimbangan pembentukan amoniak dari gas hidrogen dan gas nitrogen berikut. 3H2(g) + N2(g) ⇌ 2NH3(g) Hitung tetapan kesetimbangan pada soal nomor 2, jika dalam keadaan setimbang (suhu 300°C) 1 Liter campuran gas mengandung 0,15 mol gas hidrogen; 0,25 mol gas nitrogen; dan 0,1 mol gas amoniak.

laju reaksi, rumus laju reaksi, orde laju reaksi UN kimia 2016 pembahasan 23 YouTube
Oleh karena itu persamaan dari materi ini adalah sebagai berikut. Di mana, v= laju reaksi (mol/L/s); = perubahan mol; = perubahan waktu. Di mana, v= Laju reaksi (mol/L/s) ; k= konstanta laju reaksi; n= orde reaksi zat B; m= orde reaksi zat A. Secara logika, pada saat bereaksi, zat reaktan pasti makin berkurang, dan zat produk pasti bertambah bukan?
Pengertian Laju Reaksi Kimia, Rumus, Contoh Soal, Faktorfaktor yang Mempengaruhi ELearning
Contoh beberapa reaksi dan rumus laju reaksinya. Persamaan Laju Reaksi dan Orde Reaksi - Contoh Soal dan Jawaban. Ilustrasi dan sumber foto: PINTERpandai.com [Royalty Free] Beberapa hal yang harus dipahami terlebih dahulu sebelum menentukan persamaan laju reaksi adalah sebagai berikut: Tetapan laju reaksi (k) bergantung pada jenis reaksi dan.

Persamaan Laju Reaksi Penjelasan, Rumus, Contoh Soal dan Jawaban
V1 V 1: laju awal. T2 T 2: suhu akhir. T1 T 1: suhu awal. ΔV Δ V: faktor laju. ΔT Δ T: faktor suhu. Sehingga bila laju reaksi awal diketahui, waktu reaksi yang dibutuhkan setelah kenaikan suhu dapat diketahui lewat perumusan berikut: tt = 1 (Δv) ΔT ΔT∘ ×t0 t t = 1 ( Δ v) Δ T Δ T ∘ × t 0. Vt = 1 tt V t = 1 t t.

Contoh Soal Laju Reaksi Dan Penyelesaiannya Berbagai Contoh
Faktor yang Memengaruhi Laju Reaksi. Laju reaksi bisa dipengaruhi oleh beberapa faktor, lho! Faktor-faktor tersebut dapat mempercepat laju reaksi atau malah memperlambat laju reaksi. Faktor-faktor tersebut antara lain suhu, konsentrasi, katalisator, dan luas permukaan sentuh. Nah, kita akan bahas beberapa saja, ya.
Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11
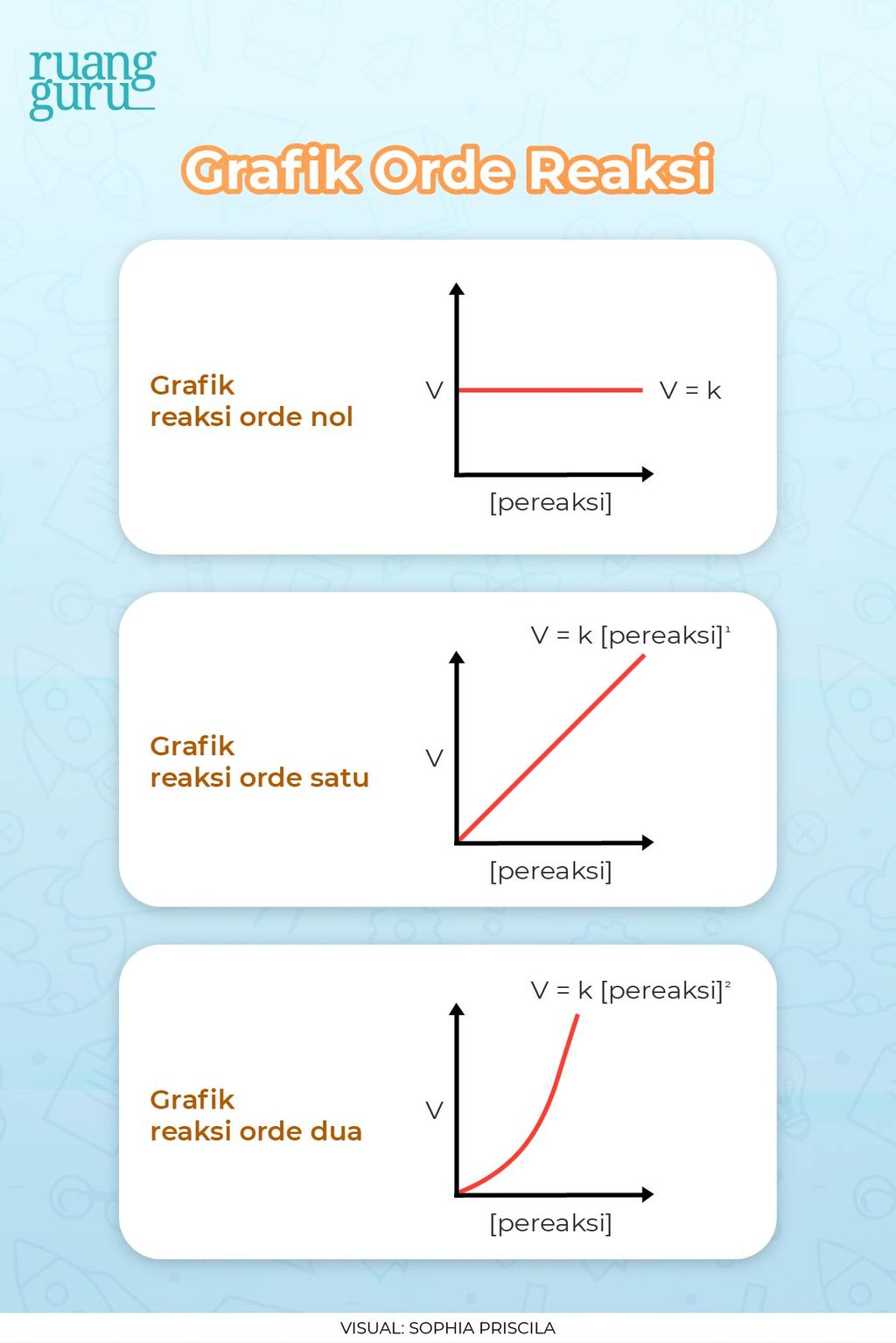
2. Orde Satu. Orde reaksi 1 atau suatu reaksi orde satu terhadap salah satu pereaksinya jika laju reaksinya berbanding lurus dengan konsentrasi pereaksi itu. Sebagai contoh bila konsentrasi pereaksi dilipat-duakan, maka laju reaksi akan menjadi kali lipatnya. Bila diplot akan terbentuk kurva berikut: 3.

Contoh Soal Laju Reaksi Dan Penyelesaiannya Berbagai Contoh
Laju Reaksi: Pengertian, Rumus, Contoh, Soal. Februari 12, 2024 Oleh Eka, S.Si. Banyak reaksi yang terjadi di sekitar kita dengan kecepatan (laju reaksi) yang berbeda-beda. Laju reaksi yang dimaksud di sini adalah laju berkurangnya jumlah reaktan atau laju bertambahnya jumlah produk dalam satuan waktu.

Menentukan Rumusan Laju Reaksi (v) dan Tetapan Laju Reaksi (k) YouTube
Laju reaksi adalah perubahan konsentrasi reaktan atau produk per satuan waktu. Besaran laju reaksi dilihat dari ukuran cepat lambatnya suatu reaksi kimia. Laju reaksi mempunyai satuan M/s (Molar per detik ). [1] Laju reaksi dilambangkan dengan v atau r. Laju reaksi atau kecepatan reaksi menyatakan bahwa banyaknya reaksi kimia yang berlangsung.

Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11 Belajar Gratis di Rumah
Laju reaksi mengacu pada kecepatan di mana reaktan bergabung dan membentuk produk, atau laju pembentukan produk dari reaktan. Berbagai faktor akan memengaruhi laju reaksi, seperti suhu, tekanan, keadaan zat, konsentrasi, dan katalis. Dengan pengetahuan tentang hukum laju reaksi dan bagaimana berbagai faktor dapat mempengaruhinya, kamu akan.

Laju Reaksi Kimia Mengenal Pengertian, Rumus, dan Faktor yang mempengaruhinya Study Education2
Dalam kinetika kimia suatu konstanta laju reaksi atau koefisien laju reaksi, k, mengukur (mengkuantifikasi) laju dari suatu reaksi kimia. [1] Bagi suatu reaksi antara reaktan A dan B untuk menghasilkan produk C. a A + b B → c C. laju reaksinya terkadang memiliki persamaan : Di sini k ( T) merupakan konstanta laju reaksi yang bergantung pada suhu.

CARA MENENTUKAN ORDE REAKSI DAN PERSAMAAN LAJU REAKSI DARI TABEL PERCOBAAN YouTube
Laju Reaksi: Konsep, Faktor, Rumus, dan Contoh Soalnya. Banyak reaksi di sekitar kita yang berlangsung secara cepat maupun lambat. Setiap reaksi kimia berlangsung dengan laju kecepatan dan kondisi tertentu. Konsep ini disebut dengan laju reaksi. Jika suatu benda memiliki konsentrasi yang sama dengan tetapan laju maka disebut dengan persamaan.

LAJU REAKSI Cara menentukan persamaan laju reaksi jika zat yang bereaksi ada tiga YouTube
Rumus Persamaan Laju Reaksi Menurut Modul terbitan Kemendikbud, konsep laju reaksi kimia untuk persamaan reaksi: A → B dirumuskan. laju reaksi dalam suatu sistem homogen pada suhu tertentu ternyata juga berbanding lurus dengan kosentrasi reaktan dan tetapan laju k, sehingga hukum laju reaksinya dapat dinyatakan sebagai berikut: X → Produk

Cara Cepat menentukan Laju Reaksi Konsep Dasar tabel MTS YouTube
4. Harga tetapan laju reaksi. Konstanta laju reaksi atau tetapan laju reaksi adalah tetapan yang harganya bergantung pada jenis pereaksi, suhu dan katalis. Tetapan laju reaksi berbanding terbalik dengan perubahan waktu. Semakin cepat reaksi berlangsung, maka harga tetapan laju reaksi semakin besar. Dan berbanding lurus dengan perubahan suhu.

WAKTU PARUH LAJU REAKSI ORDE 1, 2, DAN 3 📈 PENURUNAN RUMUS DAN CONTOH SOALNYA 🔥 YouTube
Pengertian Laju Reaksi. Laju reaksi adalah perubahan konsentrasi dari reaktan ataupun produk per satu satuan waktu. Untuk reaksi dengan reaktan A dan B menghasilkan produk C dan D seperti pada rumus persamaan reaksi berikut, seiring waktu jumlah molekul reaktan A dan B akan berkurang dan jumlah molekul produk C dan D akan bertambah, dan rumus laju reaksi (v) yaitu:

Pengertian Laju Reaksi, Rumus, Hukum, Faktor Pengaruh, dan Contohnya Ilmu Kimia
Apabila terdapat reaksi: pA + qB → rC Laju reaksinya dirumuskan sebagai berikut. Dengan: r = laju reaksi (mol.dm-3.det-1) k = tetapan laju reaksi x = tingkat reaksi (orde reaksi) terhadap A y = tingkat reaksi (orde reaksi) terhadap B [A] = konsentrasi awal A (mol.dm-3) [B] = konsentrasi awal B (mol.dm-3) Tingkat reaksi total adalah jumlah.