
Penjelasan Hukum Pertama Termodinamika dan proses isobarik isokhorik isotermal adiabatik YouTube
Perlu diketahui bahwa proses ini juga dapat diberlakukan dengan Hukum Boyle, yakni menjadi: Nah, berhubung suhunya tetap maka pada proses isotermal ini tidak akan terjadi perubahan energi dalam ∆U=O. Sementara usahanya tetap dapat dihitung dari luas daerah yang ada di bawah kurva, dengan rumus: 2. Proses Isokhorik (Volume Tetap)

Isobarik Isokhorik Isotermal
Siklus Carnot menggabungkan dua langkah proses isotermal dan dua proses adiabatik. Pada proses isotermal pertama terjadi pada temperatur lebih tinggi, zat mengalami ekspansi dan menyerap kalor.. Maka diperoleh rumus kerja untuk proses ini adalah: W 4 = C v (T 1-T 2), dimana T 1 >T 2. Total W yang dilakukan oleh mesin carnot dalam satu siklus.

Contoh Soal 2 Usaha pada Proses Isotermal YouTube
Adapun rumus untuk proses adiabatik adalah dU = Q - P.dV = - P dV. Mempelajari tentang proses-proses termodinamika dalam Sains sangat penting karena cabang ilmu tersebut sering diterapkan dalam kehidupan sehari-hari. Proses termodinamika terbagi menjadi 4 yaitu isotermal, isobarik, isokhorik, dan adiabatik.

Suatu Gas Mengalami Proses Termodinamika Seperti Ditunjukkan Pada Grafik Berikut Ruang Ilmu
Rumus Proses Isotermal adalah salah satu alat mendasar dalam studi termodinamika. Pada artikel ini kami akan menjelaskan semua yang perlu Anda ketahui tentang rumus ini, mulai dari definisi hingga penerapannya di berbagai bidang. Anda akan menemukan bagaimana proses isotermal adalah kunci untuk memahami perubahan suhu dan tekanan dalam sistem.
TERMODINAMIKA Beberapa Aplikasi Hukum Pertama Termodinamika
Untuk memahami dasar-dasar proses isotermal, pertimbangkan aksi gas dalam suatu sistem. Energi internal gas ideal hanya bergantung pada suhu, sehingga perubahan energi internal selama proses isotermal untuk gas ideal juga 0. Dalam sistem seperti itu, semua panas yang ditambahkan ke sistem (gas) melakukan kerja untuk mempertahankan proses isotermal, selama tekanan tetap konstan.

USAHA PADA PROSES TERMODINAMIK, ISOTERMAL, ISOKHORIK, ISOBARIK, ADIABATIK MATERI KELAS XI YouTube
Pelajari rumus dan penerapannya dalam kehidupan sehari-hari di sini! Hukum Boyle membahas tentang hubungan tekanan, volume, dan suhu. Pelajari rumus dan penerapannya dalam kehidupan sehari-hari di sini! Search for: Search. "Apabila suhu dari suatu gas yang ada di sebuah ruangan tertutup dijaga konstan (isotermal), maka tekanan gas tersebut.

Hukum I Termodinamika dan Contoh Soal
Proses isotermal memiliki berbagai penerapan dalam kehidupan sehari-hari, antara lain: Kulkas: Kulkas bekerja dengan menggunakan proses isotermal. Ketika pintu kulkas dibuka, panas dari lingkungan masuk ke dalam kulkas. Proses isotermal yang terjadi di dalam kulkas menjaga suhu konstan di dalamnya, sehingga makanan dan minuman tetap segar.

Proses Isotermal Pengertian Contoh Soal Fisika Proses Termodinamika My XXX Hot Girl
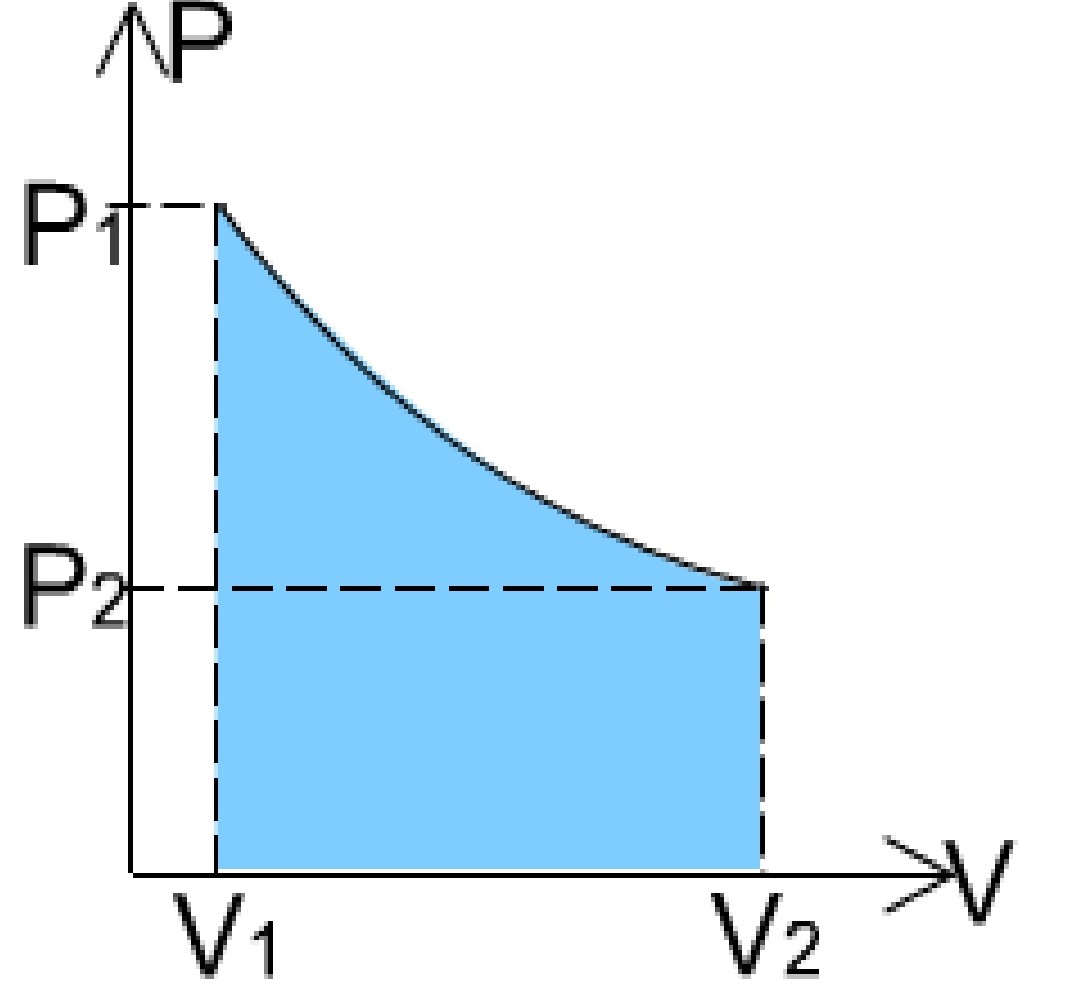
Untuk menghitung rumus usaha isotermal, kamu membutuhkan beberapa informasi seperti tekanan awal (P1), tekanan akhir (P2), volume awal (V1), dan volume akhir (V2) dari sistem isotermal yang sedang berlangsung. Setelah itu, kamu dapat menggunakan rumus usaha isotermal berikut ini: W = nRT ln (V2/V1) atau W = P1V1 ln (V2/V1) Di mana W adalah.

TERMODINAMIKA DASAR LENGKAP ISOKHORIK, ISOBARIK, ISOTERMIK, ADIABATIK YouTube
Digram proses isokhorik. Grafiknya berupa garis lurus vertikal karena volumenya tidak berubah. Tidak ada usaha yang dilakukan pada proses isokhorik. Proses isokhorik adalah perubahan keadaan gas pada volume tetap. Persamaan keadaan isokhorik: = Proses isotermis/isotermik Proses isotermik.
PENURUNAN RUMUS USAHA GAS PADA PROSES ISOTERMAL
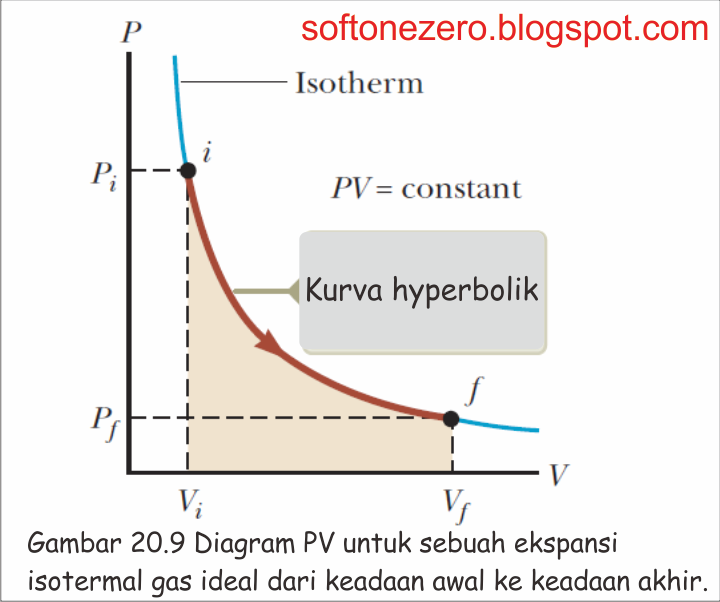
Isoterm adalah perubahan keadaan gas pada suhu yang tetap. Proses isotermal merupakan proses termodinamika yang prosesnya berjalan dan suhu gasnya tetap. Persamaan umum gasnya adalah P.V= n.R.T. Karena suhunya konstan, maka usaha yang dilakukan gas adalah: W= P.dV = n.R.T.dV/V.. Karena berlangsung dalam suhu yang kosntan, maka tidak terjadi perubahan energi dan berdasarkan hukum termodinamika.

Satu mol gas ideal mengalami proses isotermal pada suhu T...
2. Proses isotermal reversibel Jelaslah bahwa proses isotermal reversibilitas pada diagram T-S tergambar oleh garis lurus mendatar Adapun perubahan entropi diperoleh dari rumus (9-5) atau rumus (9-6) : (9-5) : V dV nR T dT dS =Cv + . Karena dT=0, maka V dV dS =nR atau i f T V V ∆S =nR ln Jelas : - Suatu ekspansi isotermal menghasilkan.

Soal dan Pembahasan Usaha Termodinamika pada Proses Isotermal dan Adiabatik YouTube
Entropi dari Proses Isotermal. Cara lain yang dapat dilakukan adalah dengan menghitung perubahan entropi (S) menggunakan perubahan panas yang terjadi (Q) dan juga adanya temperatur absolut (T). ΔS = ΔQ / T. Berdasarkan persamaan tersebut, masuk akal jika entropi meningkat untuk perubahan temperatur dari panas ke dingin. Entropi dan Energi Dalam

Persamaan Boyle Gay lussac dan penjelasan isobarik isotermal isokhorik adiabatik dan contoh soal
Pengertian Proses Isotermal dan manfaatnya. Ilmu fisika mempelajari benda dan sistem untuk mengukur gerakan, suhu, dan karakteristik fisik lainnya. Ia dapat diterapkan pada apa saja mulai dari organisme bersel tunggal hingga sistem mekanis hingga planet, bintang, dan galaksi serta proses yang mengaturnya.

Hukumhukum dan Proses pada Termodinamika
Video ini menjelaskan secara rinci mengenai termodinamika fisika kelas 11 yaitu usaha yang dilakukan oleh gas yang diproses secara isotermal (suhu tetap) dan.

Termodinamika Kerja mekanik pada proses isokhorik dan isotermal YouTube
Isothermal adalah proses atau sistem yang mempertahankan suhu konstan. Dalam proses isothermal, suhu tetap konstan karena keseimbangan antara panas yang masuk dan panas yang keluar dari sistem dijaga. Proses isothermal memiliki berbagai keuntungan dalam proses industri, termasuk penghematan energi dan mengurangi risiko kerusakan pada sistem.

Gambar Grafik Proses Adiabatik
Isothermal processes are of special interest for ideal gases. This is a consequence of Joule's second law which states that the internal energy of a fixed amount of an ideal gas depends only on its temperature. [4] Thus, in an isothermal process the internal energy of an ideal gas is constant. This is a result of the fact that in an ideal gas.