Contoh Soal Pereaksi Pembatas Dan Pembahasannya
Latihan Soal Pereaksi Pembatas (Sukar) Pertanyaan ke 1 dari 5. 1. Pertanyaan. 14 gram logam (L) direaksikan dengan 8,96 dm3 gas klorin menghasilkan garam klorida. Jika setelah reaksi terdapat 1,775 gram gas klorin, maka rumus molekul gram klorida tersebut adalah. .

Pereaksi Pembatas YouTube
Jika diketahui massa reaktan. Cari pereaksi pembatas dan pereaksi berlebih ketika 1.5 g CaCO 3 bereaksi dengan 0.73 g HCl. Tuliskan persamaan reaksi setara untuk reaksi kimia CaCO 3 + 2HCl —-> CaCl 2 + CO 2 + H 2 O. Hitung mol yang tersedia dari tiap pereaksi. mol CaCO 3 = massa ÷ MM.

PERTEMUAN11 PEREAKSI PEMBATAS LIMITING REACTION YouTube
Contoh Soal Pereaksi Pembatas. Dalam sebuah wadah tertutup, 20 gram metana (CH 4) dibakar dengan 64 gram oksigen (O 2) menghasilkan karbon dioksida dan uap air menurut reaksi dibawah. Diketahui Mr metana = 16, Ar oksigen = 16, dan Mr H 2 O = 18 . dari tabel di atas, 1,25 mol metana perlu 2,5 mol oksigen padahal hanya tersedia 2 mol oksigen.
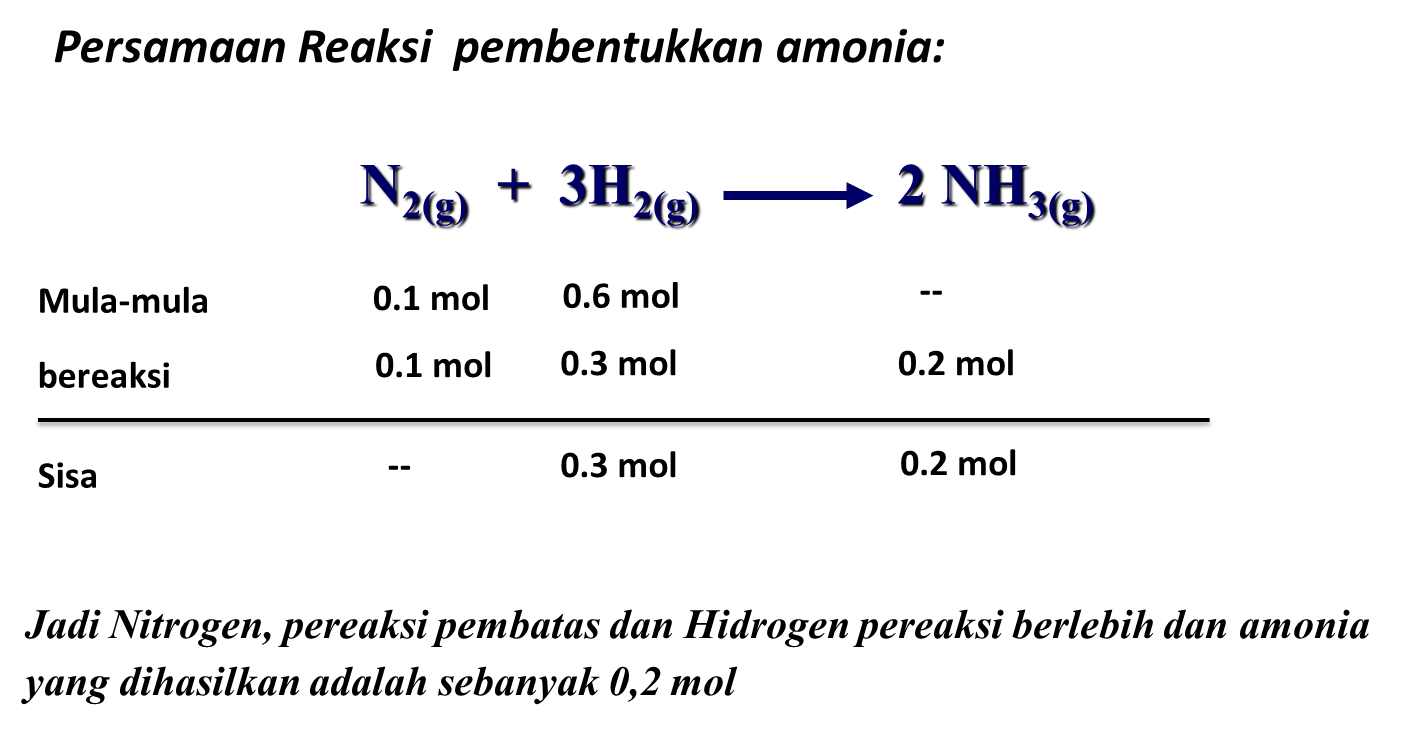
Jendela Kimia Stokiometri Pereaksi Pembatas dan Pereaksi Berlebih
PEREAKSI PEMBATAS (Stoikiometri Kimia - SBMPTN, SMA).Pereaksi pembatas adalah pereaksi yang habis lebih dulu dalam reaksi kimia.
Video belajar Pereaksi Pembatas Kimia untuk Kelas 10 IPA
Pereaksi Pembatas adalah pereaksi yang habis lebih dulu dalam sebuah reaksi kimia. Sesuai namanya, pereaksi pembatas akan membatasi jumlah produk yang dapat dihasilkan. Oleh karena itu, kita perlu mengetahui Cara Menentukan Pereaksi Pembatas dalam reaksi kimia.. Sebelum membahas lebih lanjut, mari perhatikan daftar isi berikut.

Soal Stoikiometri Reaksi (Pereaksi Pembatas) Urip dot Info
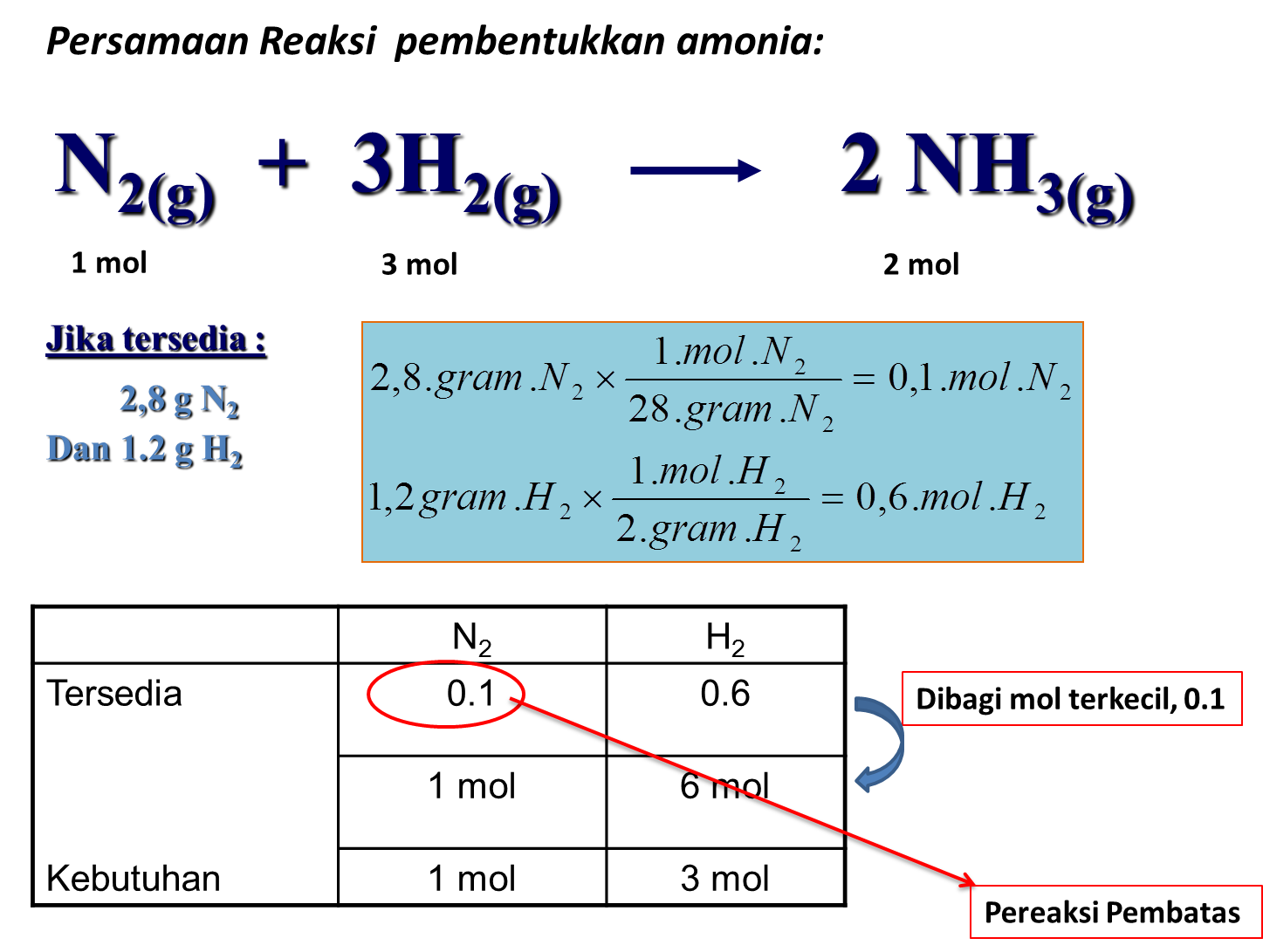
Untuk lebih memahami materi pereaksi pembatas, perhatikan 5 contoh soal pereaksi pembatas dan pembahasannya berikut ini. Contoh Soal Pereaksi Pembatas dan Pembahasannya Pilihan Ganda Soal No. 1 Amonia dapat dibuat melalui reaksi: N2(g) + 3H2(g) → 2NH3 Jika 60 liter gas nitrogen direaksikan dengan 240 liter gas hidrogen yang diukur pada suhu dan tekanan yang

Pereaksi Pembatas Soal dan Pembahasan KIMIA KELAS 10 YouTube
Pengertian Pereaksi Pembatas. Dalam suatu reaksi kimia, tidak selalu massa zat-zat yang bereaksi (zat reaktan) habis bereaksi seluruhnya membentuk hasil reaksi. Kadang-kadang, salah satu dari zat reaktan memiliki massa yang bersisa karena tidak habis bereaksi.

Pereaksi Pembatas Stoikiometri YouTube
Untuk semakin mendalami materi pereaksi pembatas yang dijelaskan di atas, kamu bisa tengok di Wardaya College. Kamu akan mendapatkan beberapa video beserta contoh soal stoikiometri reaksi kimia. Video pembelajaran diberikan dengan gaya yang enak dan mudah dipahami. Contoh soalnya dibuat dengan 3 tingkat kesulitan yang bisa kamu kerjakan.

Pereaksi Pembatas Latihan Soal (Kimia SBMPTN, UN, SMA) YouTube
Rumus empiris merupakan rasio bilangan bulat paling sederhana dari jumlah mol dari masing-masing unsur dalam suatu senyawa. Rumus molekuler merupakan jumlah mol sebenarnya dari masing-masing unsur dalam 1 mol senyawa.. Setelah pereaksi pembatas habis, tidak ada lagi produk reaksi yang terbentuk. Jadi, jumlah pereaksi pembatas menentukan.

Kimia mol pada pereaksi pembatas contoh soal YouTube
gram H 2 O = (96 x 1/32 x 2 x 18) gram H 2 O. gram H 2 O = 108 gram O 2 O. Lebih banyak air yang terbentuk dari 20 gram H2 daripada 96 gram O2 . Oksigen adalah reaktan pembatas. Setelah 108 gram H2O terbentuk , reaksi berhenti. Untuk menentukan jumlah sisa H 2 berlebih , hitunglah berapa banyak H 2 yang dibutuhkan untuk menghasilkan 108 gram H.

Pereaksi Pembatas
Hasil mol koefisien HCl < Fe, sehingga HCl sebagai pereaksi pembatas. Selanjutnya jumlah mol dari limiting reagent inilah yang menentukan jumlah mol reaksi/hasil reaksi. Misal dari contoh soal tersebut ditanyakan massa FeCl2 yang terbentuk, sehingga. nFeCl2 = 1 2 × mol HCl = 1 2 × 0, 1 mol = 0, 05 mol mFeCl2 = 0, 05 × 127 gram = 6, 35 gram.

cara mencari pereaksi pembatas Stoikiometri kimia kelas 10 YouTube
Adapun rumus-rumus yang biasa digunakan dalam menyelesaikan stoikiometri adalah sebagai berikut. Pengertian Pereaksi Pembatas. Membahas reaksi kimia, sama artinya membahas zat pereaksi dan produk hasil reaksi. Zat pereaksi biasanya ditulis di ruas kiri, sedangkan produk ditulis di ruas kanan.
Contoh Soal Pereaksi Pembatas Beserta Jawabannya Ruang Siswa
Rumus Kimia; Definisi; ️ Practice; Chemistry Quizzes Bantuan. Chat; Forum ID Indonesia Log Masuk. Kalkulator Reagen Pembatas. Kalkulator ini akan menentukan reagen pembatas reaksi. 🛠️ Hitung Reagen Pembatas.

Kimia Kelas x Cara Menentukan Pereaksi Pembatas. YouTube
Pembahasan soal pereaksi pembatas nomor 1. Jadi zat yang tersisa adalah belerang (S) sebesar 0,125 mol atau massa S tersisa = mol x Ar S = 0,125 x 32 g = 4 gram. Soal ini jawabannya B. Contoh soal pereaksi pembatas nomor 2. Diketahui reaksi: Fe + S → FeS. Jika 10 g besi dicampur dengan 3,2 g S, massa FeS yang dihasilkan (Ar Fe = 56, S = 32.

PEREAKSI PEMBATAS YouTube
Contoh soal ini menunjukkan metode untuk menentukan reaktan pembatas dari suatu reaksi kimia. Menu. Rumah. Sains, Teknologi, Matematika Sains. Hitung Rumus Paling Sederhana Dari Komposisi Persen. Kimia. Masalah Hasil Teoretis Bekerja.. Perlu Menghitung Pereaksi Pembatas Reaksi Kimia? 26 Nov, 2019. Pelajari Cara Menghitung Hasil Teoretis.

STOIKIOMETRI 3 Rumus empiris dan Pereaksi Pembatas YouTube
Langkah 2. Menyetarakan persamaan reaksi. Fe (s) + S (s) → FeS (s) Langkah 3. Mencari perbandingan mol dan menentukan zat yang habis bereaksi. Zat yang habis bereaksi ini berperan sebagai pereaksi pembatas dan zat yang tidak habis bereaksi berperan sebagai pereaksi sisa. Perbandingan mol Fe = jumlah mol Fe/koefisien Fe = 0,5/1 = 0,5 mol.