
Pengertian dan Rumus Kenaikan titik didih larutan
Tb = 100 + 0,6656 = 100,6656 °C. Contoh soal 6 (UN 2019) Perhatikan percobaan pengukuran titik didih gula (glukosa) dan garam dapur (NaCl) berikut. Contoh soal 6. Jika Mr NaCl = 58,5 dan Mr glukosa = 180 dan Tb air = 100 C, tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah…. A. 0,52 °C/m.
Memahami Rumus Kenaikan Titik Didih Suatu Larutan Halaman 2 Nasional Katadata.co.id
Tb = 100°C + ΔTb. = 100°C + 0,0416°C = 100,0416°C. Jadi, Tidik didih larutan tersebut yaitu 100,0416°C. Itulah ulasan mengenai √ Titik Didih : Pengertian, Kenaikan, Faktor, Rumus & Contoh Soalnya Lengkap. Semoga apa yang telah diulas dapat bermanfaat bagi pembaca. Sekian dan terima kasih.

PENURUNAN TEKANAN UAP DAN KENAIKAN TITIK DIDIH YouTube
Hal ini disebabkan adanya kenaikan titik didih yang harus mencapai suhu/ titik didih zat terlarut. 3. Penurunan titik beku Titik beku adalah suhu pada tekanan tertentu yang menyebabkan perubahan zat dari cair ke wujud padat.. Nilai dari sifat-sifat koligatif larutan dapat diketahui dengan persamaan rumus berikut ini: Penurunan tekanan uap.

Contoh Soal Perbandingan Penurunan Titik Beku (Sifat Koligatif Larutan Elektrolit) YouTube
Rumus kenaikan titik didih adalah salah satu konsep penting dalam kimia fisika yang sering digunakan dalam berbagai aplikasi, terutama dalam industri dan laboratorium.. Rumus penurunan titik beku digunakan untuk menghitung besarnya penurunan titik beku berdasarkan konstanta molalitas pelarut, molalitas zat terlarut, dan faktor van 't Hoff.

10 Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Materi
KOMPAS.com - Berikut cara menghitung kenaikan titik didih dan penurunan titik beku pada larutan elektrolit, serta cara menentukan faltor van't hoff larutan elektrolit:. Soal: Sebanyak 8,7 gram potassium sulfat (K2SO4) dilarutkan kedalam 250 gram air.Maka, kenaikan titik didihnya adalah… 0,312 derajat celcius; 0,624 derajat celcius; 1,312 derajat celcius.

10 Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Materi
Kenaikan titik didih adalah salah satu dari empat sifat koligatif larutan, yaitu sifat larutan yang dipengaruhi oleh partikel zat pelarut. Kenaikan titik didih larutan adalah peristiwa di mana titik didih suatu larutan akan lebih tinggi daripada pelarut murninya. Misalnya, air memiliki titik didih 100 derajat celcius.
Contoh Soal Penurunan Titik Beku Dalam Kehidupan Sehari Hari Reverasite
Pengertian Penurunan Tekanan Uap, Rumus, dan Contoh Perhitungannya. by Wilman Juniardi & Andjar Tyassih, S.Si. Januari 29, 2023. Sudah masuk semester baru, saatnya belajar materi baru untuk Kimia di kelas 12. Materi yang akan kamu pelajari pertama kali adalah sifat koligatif larutan, salah satunya penurunan tekanan uap.

Pengertian Titik Didih Larutan Dalam Ilmu Kimia LABORATORIUM SMK
Kenaikan Titik Didih dan Penurunan Titik Beku - Mari sobat kita lanjutkan materi kita tentang sifat koligatif larutan. Pada postingan sebelumnya telah dibahas tentang penurunan tekanan uap. Sekarang kita akan bercerita panjang lebar tentang sifat koligatif larutan Kenaikan titik didih dan Penurunan Titik Beku. Kita akan belajar tentang kedua sifat tersebut berikut rumus dan contoh […]

Menentukan Rumus Molekul Senyawa dari Penurunan Titik Beku YouTube
Selisih titik beku pelarut (Tf o) dengan titik beku larutan (Tf) yang kemudian disebut penurunan titik beku (ΔTf). Berikut rumus penurunan titik beku: ΔTf = Tf° - Tf. Menurut Hukum Backman dan Raoult, penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang ikut terlarut di dalamnya.

PERCOBAAN III SIFAT KOLIGATIF LARUTAN PENURUNAN TITIK BEKU (Kimia Dasar I) Blog Najih
Rumus ini menghubungkan kenaikan titik didih (ΔTb), molalitas (m), konstanta ebullioskopik (Kb), dan faktor van't Hoff (i) dari zat terlarut dalam larutan. Perhatikan bahwa dalam kasus senyawa kovalen atau molekul non-elektrolit, nilai faktor van't Hoff (i) biasanya adalah 1, karena senyawa ini tidak mengionisasi dalam larutan.
Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
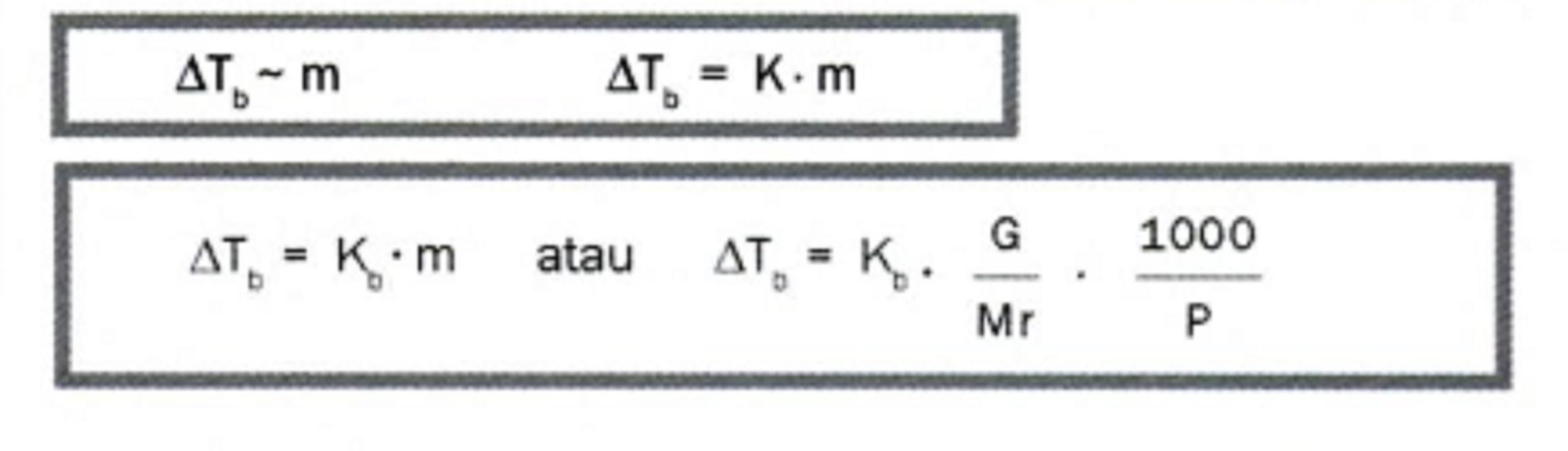
ΔTb = kenaikan titik didih Kb = tetapan kenaikan titik didih molal ΔTf = penurunan titik beku Kf = tetapan titik beku molal m = molalitas Syarat Hukum Backman dan Raoult adalah sebagai berikut. a. Rumus di atas berlaku untuk larutan nonelektrolit. b. ΔTb tidak berlaku untuk larutan yang mudah menguap. c. Hanya berlaku untuk larutan yang.

Kenaikan Titik Didih Penurunan Titik Beku Sifat Koligatif Larutan Reverasite
Berapa kenaikan titik didih dan penurunan titik beku larutan pada tekanan 1 atm jika 1,28 gram naftalena (C10H8) terlarut dalam benzena (C6H6) 200 gram. Jawaban: misalkan massa pelarut benzena nya 200 gram Kb air= 0,52 °C/m Kf air= 1,86 °C/m Mr naftalen= 128. maka ΔTb= massa ter/ Mr ter X 1000/ massa pelarut X kb = 1,28/128 X 1000/200 X 0,52

Materi Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Selisih antara titik didih larutan dengan titik didih pelarut inilah yang disebut dengan kenaikan titik didih ( ∆T b ). Rumus untuk menentukan kenaikan titik didih ( ∆T b ) adalah: Untuk larutan yang bersifat elektrolit, maka persamaannya akan berubah menjadi: T b = K b . m [ 1 + ( n - 1 ) α ]

Contoh Soal Titik Didih Homecare24
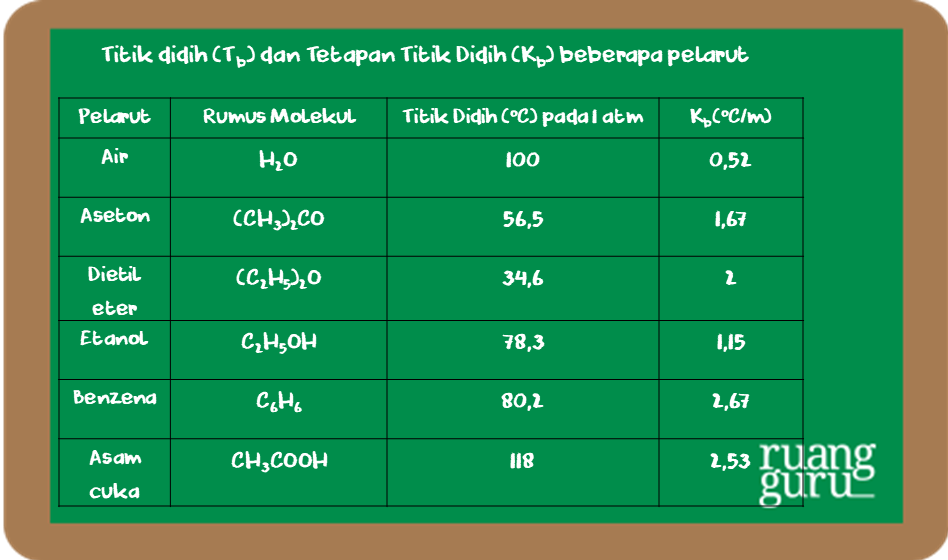
Untuk dapat membandingkan titik didih beberapa zat, di bawah ini diberikan data titik didih larutan dan tetapannya (K b). Untuk menentukan nilai kenaikan titik didih larutan dapat digunakan persamaan sebagaimana penentuan penurunan titik beku larutan. Persamaan yang digunakan adalah: ∆Tb = Tb (larutan) - Tb (pelarut) ∆Tb = m . Kb. Dengan.

Rumus Kenaikan Suhu Kimia Bit CDN
Titik lebur. Titik lebur atau titik leleh adalah suatu kondisi suhu saat benda padat meleleh menjadi cair. Sementara itu, titik lebur suatu zat dipengaruhi oleh: Tekanan. Artinya, jika tekanan pada zat dinaikkan, maka titik lebur zat akan turun, sebaliknya jika tekanan zat diturunkan, maka titik lebur zat akan naik.

Rumus titik beku larutan
1. Titik Beku (Tf) Jadi begini , proses pembekuan itu terjadi ketika suatu zat telah mencapai titik beku. Titik beku ( Tf) akan tercapai apabila temperatur saat tekanan uap zat padat, sama dengan tekanan uap zat cair. Jika kalian mengetahui bahwa titik beku air sebesar 0ºC, itu artinya tekanan uap air dalam bentuk cair pada temperatur 0ºC.