
Rumus Kelarutan S My XXX Hot Girl
Dalam konteks kimia, Ksp biasanya digunakan untuk menghitung seberapa larut suatu senyawa ionik dalam air atau pelarut lainnya. Secara matematis, rumus Ksp dapat dituliskan sebagai: Ksp = [ion A]^a [ion B]^b. Di mana [ion A] dan [ion B] mewakili konsentrasi ion-ion yang terlarut dalam pelarut, sedangkan a dan b mewakili koefisien stoikiometri.

Hubungan Ksp dengan pH kimia SMA YouTube
Rumus hasil kali kelarutan (KSP) Ag2CrO4 dinyatakan sebag… from colearn.id Pendahuluan. Kimia adalah ilmu yang mempelajari tentang struktur, sifat, dan reaksi dari materi. Salah satu konsep penting dalam kimia adalah kesetimbangan kimia. Kesetimbangan kimia terjadi ketika reaksi berbalik dan maju dengan kecepatan yang sama.

Kelarutan (s) dan Hasil Kali Kelarutan (Ksp) Soal dan Pembahasan KIMIA KELAS 11 YouTube
Rumus Ksp digunakan untuk menghitung seberapa banyak suatu senyawa dapat larut dalam air pada suhu tertentu. Kenapa Rumus Ksp Penting? Rumus Ksp sangat penting dalam kimia karena membantu kita memahami seberapa banyak suatu senyawa dapat larut dalam air. Hal ini sangat berguna dalam proses pembuatan obat-obatan, pupuk, dan bahan kimia lainnya..

Reaksi Asam Basa Rumus Kimia Contoh Soal Dan Jawaban Riset
The equilibrium constant for a dissolution reaction, called the solubility product ( Ksp ), is a measure of the solubility of a compound. Whereas solubility is usually expressed in terms of mass of solute per 100 mL of solvent, Ksp is defined in terms of the molar concentrations of the component ions. In contrast, the ion product ( Q) describes.

massa endapan, ksp, kelarutan, UN kimia 2016 pembahasan 16 YouTube
Video ini berisi penjelasan dan animasi tentang kelarutan dan hasil kali kelarutan (Ksp) yang dilengkapi dengan contoh-contoh soal.Video terkait :Pengaruh pe.
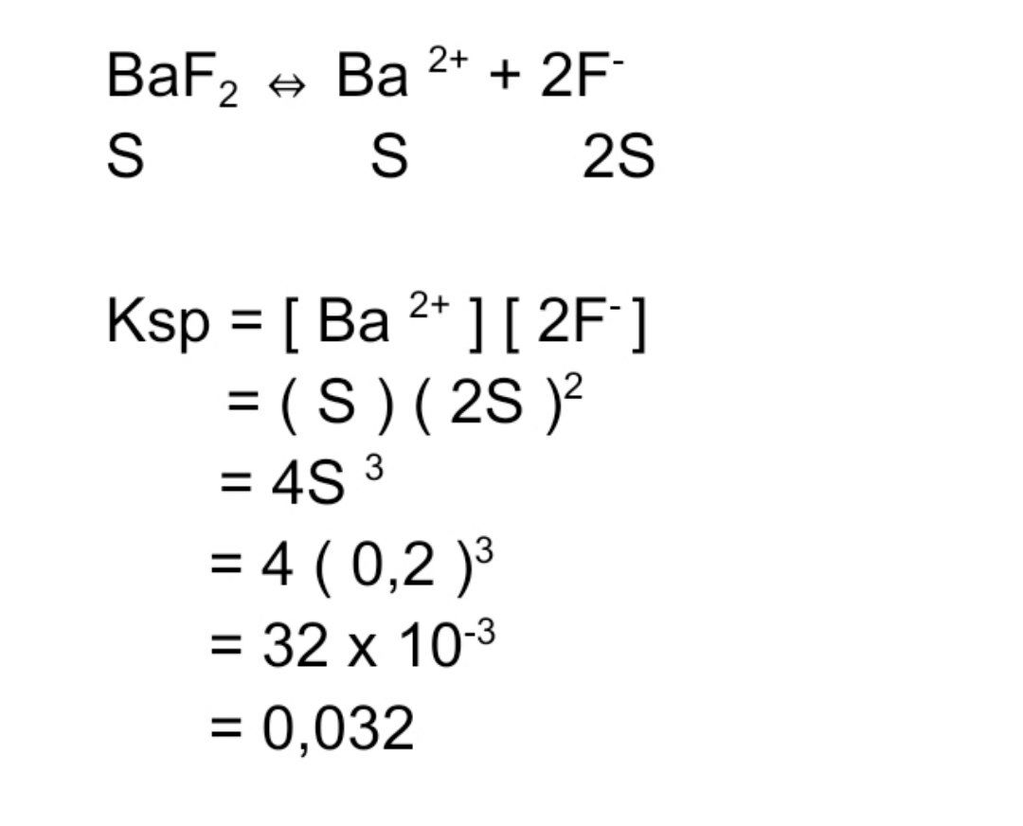
Tentukan besarnya Ksp senyawa berikut. 350 gram Ba...
Hubungan Kelarutan (s) dan Tetapan Hasil Kali Kelarutan (K sp) Kelarutan dari suatu zat dapat berubah bergantung pada beberapa faktor. Misalnya, kelarutan dari senyawa hidroksida seperti Mg (OH) 2, bergantung pada pH larutan. Kelarutan zat juga dipengaruhi oleh konsentrasi ion-ion lain dalam larutan, khususnya ion-ion senama.

Kumpulan Contoh Soal Kesetimbangan Larutan (Ksp) Kimia Kelas 11 CoLearn halaman 11
Definisi KSP Kimia. KSP Kimia adalah produk dari konsentrasi ion-ion dalam larutan yang berada dalam kesetimbangan dengan senyawa padat yang tidak larut. Ini dinyatakan dengan persamaan matematika: KSP = [A+] x [B-], di mana A+ dan B- adalah ion yang terlarut dalam larutan.

Soal Tentukan rumus Ksp dari CuCl!
Hubungan Antara Kelarutan dan Ksp. Pada larutan jenuh senyawa ion A x B y, konsentrasi zat di dalam larutan sama dengan harga kelarutannya dalam satuan mol/L. Senyawa A x B y yang terlarut akan mengalami ionisasi dalam sistem kesetimbangan. Jika harga kelarutan dari senyawa A x B y sebesar s M, maka di dalam reaksi kesetimbangan tersebut konsentrasi ion-ion dan ionnya adalah sebagai berikut :

Pembahasan Kimia Erlangga Kelarutan Dan Ksp Latihan 8.4 tips and trik 5
Pengertian KSP Kimia.. Kemudian, dilakukan perhitungan dengan menggunakan rumus yang sesuai untuk senyawa tersebut. Hasil perhitungan adalah nilai KSP yang menunjukkan tingkat kelarutan senyawa tersebut dalam air. Contoh Soal Penghitungan KSP. Misalnya, diberikan data kelarutan AgCl sebesar 1,6 x 10^-5 M. Berapa nilai KSP dari AgCl?

Tuliskan Persamaan Ion dan RumusRumus Ksp nya, jika zatzat berikut dilarutkan ke dalam air
Dalam penentuan kelarutan dari data Ksp atau penentuan Ksp dari data kelarutan tidak terlalu sulit namun dalam proses hitungnya sedikit perlu waktu untuk menyelesaikannya. Untuk itulah kalkulator ini dibuat.. Rumus Kimia K sp (pada 25 o C) Aluminium hidroksida: Al(OH) 3: 3 × 10-34: Aluminium fosfat: AlPO 4: 9.84 × 10-21: Barium bromat: Ba.

Kelarutan dan ksp soal kimia SMA YouTube
Tetapan Hasil Kali Kelarutan (Ksp) - RumusKimia.net kali ini akan berbagi materi kimia tentang Rumus Tetapan Hasil Kali Kelarutan dan Contoh Soal Penyelesaian. Dalam suatu larutan jenuh dari suatu elektrolit yang sukar larut, terdapat kesetimbangan antara zat padat yang tidak larut dan ion-ion zat itu yang larut. MxAy (s) ⇄ x My+(aq) + y Ax.

Reaksi Pengendapan ( Ksp ) KIMIA SMA YouTube
kelarutan (solubility) adalah jumlah maksimal zat yang dapat larut dalam sejumlah tertentu pelarut. Kelarutan dapat dinyatakan dalam satuan mol/L. Kelarutan disimbolkan "s". Kelarutan suatu zat bisa juga dinyatakan sebagai massa dalam gram yang dapat melarut dalam 100 gram pelarut membentuk larutan jenuh pada suhu tertentu atau mol per liter larutan.
Tuliskanlah rumus kelarutan(Ksp) dari senyawa beri...
Karena garam-garam ini adalah elektrolit, maka garam yang terlarut akan terionisasi, sehingga dalam larutan akan terbentuk suatu kesetimbangan. Hasil kali kelarutan (Ksp) → hasil kali konsentrasi ion-ion dari larutan elektrolit jenuh atau sukar larut dipangkatkan koefisiennya. Ksp = [Al3+] . [OH-]3. Kelarutan dalam air.

Rumus Ksp Kimia Kelas 12 Bit CDN
Kelarutan (solubility) adalah jumlah maksimum suatu zat yang dapat larut dalam suatu pelarut. Satuan kelarutan umumnya dinyatakan dalam gram/L atau mol/L (M). Hasil kali kelarutan ( Ksp) dinyatakan sebagai hasil kali ion-ion (satuan Molar) dalam larutan jenuhnya, dengan masing-masing konsentrasi dipangkatkan koefisiennya.

Rumus Ksp Kimia Kelas 12 Bit CDN
Tuliskan rumus tetapan hasil kali kelarutan untuk senyawa Mg(OH) 2! Pembahasan: Mg(OH) 2 dalam larutan akan terurai menjadi ion-ionnya, Mg(OH) 2 ⇄ Mg 2 + + 2OH - Maka dari rumus Ksp diperoleh Ksp = [Mg 2+][OH -] 2. Contoh soal 3 : Pada suhu tertentu, kelarutan AgIO 3 adalah 2 × 10 -6 mol/L, tentukan harga tetapan hasil kali.

Cara Mentukan Rumus Ksp Kimia Bit CDN
Kelarutan dan Hasil Kali Kelarutan - Kimia Kelas 11. Ksp, larutan berada pada kondisi lewat jenuh (ada endapan). Untuk meningkatkan pemahaman Quipperian tentang materi kelarutan dan hasil kali kelarutan, simak contoh soal berikut. Contoh soal 2 Kelarutan Ag2CrO4 dalam air adalah 10-4 M. Tentukan kelarutan Ag2CrO4 dalam larutan K2CrO4 0,01 M!