
Kimia 12 Molaritas Molalitas dan Fraksi Mol YouTube
Rumus normalitas kimia adalah N = n x a /V, yang menyatakan nilai normal (N) yang sama dengan satu mol ekivalen/liter. Dalam kimia, terdapat beberapa besaran yang dapat digunakan untuk menyatakan suatu konsentrasi zat terlarut dalam sebuah larutan antara lain yaitu molaritas, molalitas, normalitas dan fraksi mol.

Rumus Fraksi Mol Pengertian, Sifat dan Contoh Soalnya Lengkap BprsKu.Co.Id
Jika sebuah entitas molekul terdisosiasi dalam larutan, maka konsentrasinya mengacu pada rumus kimia asli dalam larutan, dan molaritasnya kadang-kadang disebut konsentrasi formal atau formalitas ( FA) atau konsentrasi analitis ( cA ). Misalnya, jika larutan natrium karbonat (Na 2 CO 3) memiliki konsentrasi formal c (Na 2 CO

Persen Berat, Persen Volume, Molaritas, Molalilas, Fraksi Mol (Konsentrasi Larutan) YouTube
Pada ilmu kimia, banyaknya suatu zat atau senyawa seringkali dinyatakan pada besaran mol. Besaran konsentrasi molaritas, molalitas, normalitas, dan fraksi mol memakai satuan kuantitas zat atau senyawa dalam mol. Mol yaitu gram zat dibagi dengan massa molekul relatif (Mr). Rumus menghitung mol suatu senyawa yaitu : n = gram/Mr Keterangan:

Pengertian Rumus Dan Contoh Soal Mol Molalitas Molaritas Dan Riset My XXX Hot Girl
1. Molaritas (M) Molaritas adalah banyaknya mol zat yang terlarut dalam 1 liter larutan. Keterangan: M = molaritas, Mr = massa molar zat terlarut (g/mol), V = volume larutan Contoh: Berapakah molaritas 9.8 gram H2SO4 (Mr= 98) dalam 250 ml larutan ? - molaritas H2SO4 = (9.8/98) mol / 0.25 liter = (0.1 x 4) mol / liter = 0.4 M

Cara mudah mencari molaritas atau konsentrasi larutan soal kimia SMA YouTube
Rumus standarnya adalah C = m/V, yaitu C adalah konsentrasi, m adalah massa zat terlarut, dan V adalah total volume larutan. Kalau larutan Anda berkonsentrasi kecil, carilah jawabannya dalam bagian per juta (bpj) supaya lebih mudah dipahami. Saat di laboratorium, Anda bisa diminta mencari molaritas atau konsentrasi molar larutan terkait. Metode 1

Satuan Konsentrasi Ppm, , Molaritas dan contoh soal YouTube
Molaritas. Dalam ilmu kimia, molaritas (disingkat M) salah satu ukuran konsentrasi larutan. Molaritas suatu larutan menyatakan jumlah mol suatu zat per liter larutan. Misalnya 1.0 liter larutan mengandung 0.5 mol senyawa X, maka larutan ini disebut larutan 0.5 molar (0.5 M). Umumnya konsentrasi larutan berair encer dinyatakan dalam satuan molar.

apa perbedaan molalitas dan molaritas Brainly.co.id
Konsentrasi molar dari larutan didefinisikan sebagai banyaknya mol zat terlarut dalam setiap liter larutan. Jadi, molaritas menyatakan perbandingan antara jumlah mol zat dengan volume dalam liter suatu larutan. Rumus Molaritas. Untuk dapat menentukan konsentrasi dari suatu larutan, diperlukan cara yang tepat untuk menghitungnya.

Contoh soal MOLARITAS YouTube
1. Super Lengkap Rumus IPA SMA Kelas 10, 11, & 12 2. Logic Magic Fisika, 1 Menit Pecahkan Soal Fisika IPA SMA Kelas 12 3. Super Smart Kuasai Matematika Dan IPA SMA / MA kelas 10, 11, dan 12 4. Panduan Praktikum Kimia SMA: Konsep dan Skill Laboratorium Kategori Ilmu Kimia Materi Terkait Normalitas

Pengertian Molaritas, Rumus dan Contohnya
Rumus Molaritas Sebenarnya dari definisi molaritas ini sudah bisa diketahui rumusnya. Namun, supaya lebih jelas, berikut penulisan rumus molaritas jika volume larutan dalam bentuk liter dengan satuan mol/L.
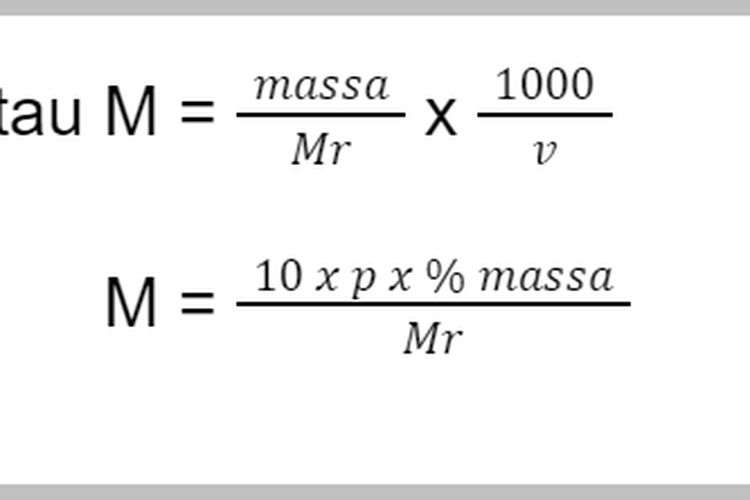
Pahami Rumus Molaritas, Contoh Soal, dan Pembahasannya Berikut Ini
Fraksi Mol Penerapan Dalam Kehidupan Sehari-hari Contoh Soal Referensi Pengantar Larutan merupakan campuran homogen yang terdiri dari zat terlarut dan pelarut. Secara umum, pelarut merupakan komponen yang lebih banyak dibanding zat terlarut dalam larutan. Zat terlarut dan pelarut ini dapat berfasa solid (padat), liquid (cair), atau gas.

Rangkuman rumus kimia uts Satuan konsentrasi larutan Molaritas (M) = Mol zat terlarutliter
Rumus molaritas. Foto: Kholida Qotrunnada/detikcom Keterangan: M = molaritas (mol/L) n = mol zat terlarut (mol) V = volume larutan (Liter) Mr = massa molekul relatif v = volume larutan (mL) Di mana, mol zat terlarut bisa dihitung dengan membagi massa zat terlarut (dalam gram) dengan massa rumus relatif zat terlarut.

Pengertian Dan Rumus Molaritas Dan Contoh Soal Molaritas Lengkap Riset Riset
1 Ketahui rumus dasar untuk menghitung molaritas. Molaritas adalah jumlah mol terlarut dibagi dengan volume larutan dalam liter. [1] Dengan demikian, ditulis sebagai: molaritas = mol larutan / liter larutan Contoh soal: Berapa molaritas dari larutan yang mengandung 0,75 mol NaCl dalam 4,2 liter? 2 Teliti soalnya.

Hitunglah konsentrasi molaritas 2.10^25 molekul ur...
Pengertian molaritas. Molaritas adalah ukuran yang mengemukakan konsentrasi suatu larutan. Dilansir dari Chemistry LibreText, molaritas adalah jumlah mol zat terlarut dalam satu liter larutan. Molaritas disimbolkan sebagai M dan memiliki satuan mol per liter (mol/L) atau molar, sehingga molaritas juga kerap disebut sebagai konsentrasi molar.

Soal 3. Konversi satuan konsentrasi ppm ke molaritas YouTube
Rumus Konsentrasi Larutan Satuan Konsentrasi Larutan 1. Molaritas (M) 2. Molalitas (m) 3. Normalitas (N) 4. Fraksi mol 5. Konsentrasi dalam persen a, Persen berat (%W/W) b. Persen volume (%V/V) c. Persen berat volume (%W/V) 6. Parts Per Million (ppm) dan Parts per Billion (ppb) 7. Keformalan (F) KONSENTRASI LARUTAN DALAM SATUAN KIMIA DAN FISIKA

Cara Menghitung Konsentrasi Larutan Dalam Persen
Konsentrasi larutan dalam satuan kimia ini tidak hanya dinyatakan dalam molaritas, molalitas, dan fraksi mol saja, tapi juga dapat dinyatakan dalam bentuk normalitas.. Jika pada soal diketahui molaritas suatu zat, maka gunakan rumus berikut untuk mencari normalitasnya: N = molaritas x ekuivalen. N = 0,1 x 2. N = 0,2 N.

XI.4.c. Menentukan Molaritas dari Pencapuran Beberapa Konsentrasi Larutan (Teori) YouTube
9. Molaritas campuran. Jika dua jenis larutan dengan konsentrasi berbeda dicampurkan, maka akan terbentuk larutan baru dengan konsentrasi tertentu. Konsentrasi larutan setelah dicampur dirumuskan sebagai berikut. Bagaimana Quipperian, cukup banyak ya rumus yang harus kamu hafalkan. Akan tetapi, Quipperian tidak perlu khawatir.