
SOLUTION Rumus sifat koligatif larutan kimia kelas xii 2021 Studypool
Ketiga jenis konsentrasi larutan tersebut dapat digunakan untuk menghitung sifat koligatif larutan dengan berbagai kasus. Berikut ini klasifikasi sifat koligatif larutan dalam ilmu Kimia yang perlu diperhatikan. Baca Juga: Rumus Pengenceran Larutan beserta Penjelasan Konsepnya.

Rumus Sifat Koligatif Larutan Non Elektrolit Dan Elektrolit PDF
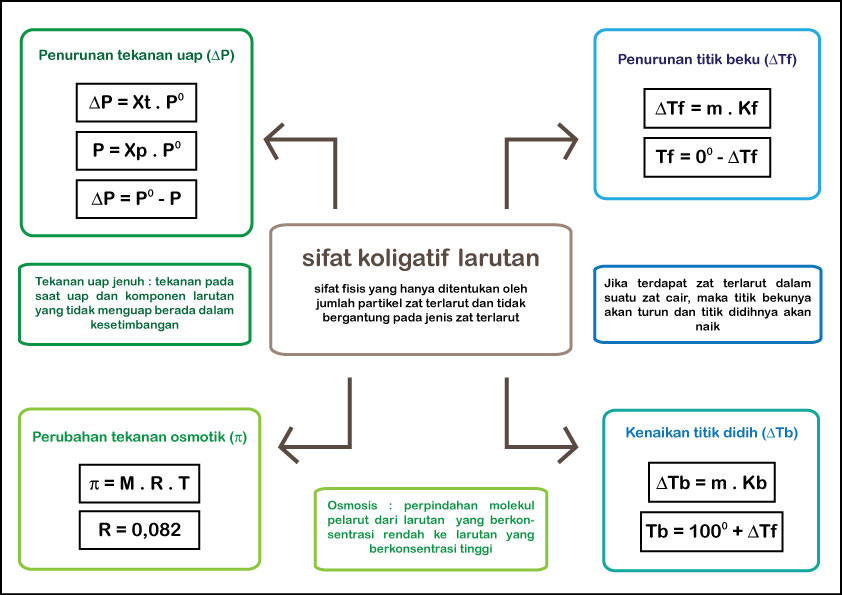
Sifat koligatif sendiri hanya memandang "kuantitas", bukan "kualitas". Oleh sebab itu, sifat larutan, seperti rasa, warna, dan kekentalan (viskositas) merupakan sifat-sifat yang bergantung pada jenis zat terlarut yang tercampur dalam larutan. Terdapat empat sifat koligatif larutan, yaitu penurunan tekanan upa, kenaikan titik didih.

Rangkuman Materi Sifat Koligatif Larutan Rumus Kimia Reverasite
ΔP = Xter x P0. Zat terlarut menurunkan tekanan uap pelarut. sifat koligatif. Rumus sifat koligatif larutan mempunyai delapan rumus yang terbagi menjadi empat rumus sifat koligatif larutan non elektrolit dan empat rumus sifat koligatif larutan elektrolit.

Rumus Sifat Koligatif Larutan Dan Contoh Soal Terbaru
Pengertian Sifat Koligatif Larutan, 4 Jenis, Rumus, Contoh Soal dan Jawaban. Sifat koligatif adalah sifat alami yang dimiliki oleh suatu larutan dengan zat terlarut tertentu. Pelarut murni akan memiliki sifat yang sangat berbeda daripada sifat pelarut yang sudah dicampur dengan zat terlarut atau disebut dengan larutan, sifat itulah yang disebut.

Sifat Koligatif Larutan Penurunan Titik Beku Sains Kimia Unamed
Jika diperhatikan, rumus sifat koligatif antara larutan elektrolit dan non-elektrolit hampir sama. Perbedaanya hanya terletak pada keberadaan simbol 𝑖 yang merupakan faktor Van't Hoff. Secara sederhana, faktor Van't Hoff bisa diartikan sebagai pertambahan jumlah partikel yang terjadi akibat proses ionisasi pada suatu larutan elektrolit.

7 Soal Un Sifat Koligatif Larutan Lengkap Dengan Pembahasannya Materi Reverasite
Penurunan Titik Beku. Rumus Persamaannya adalah : ΔTf = kf x m x i. 4. Tekanan Osmotik. Rumus Persamaannya adalah : π = M x R x T x i. Demikianlah bahasan kita mengenai sifat koligatif larutan. Terima kasih bagi yang menyempatkan waktu untuk membaca dan mampir di artikel √ Sifat Koligatif Larutan : Pengertian, Sifat, Rumus & Contohnya Lengkap.

Sifat Koligatif Larutan Lengkap Dengan Contoh Dan Penjelasannya Rumus My XXX Hot Girl
Kesimpulannya, sifat-sifat koligatif larutan membuat kita memahami bagaimana larutan dapat memengaruhi perubahan fisik suatu zat. Nah, setelah membaca artikel ini, kita telah mengetahui rumus untuk 4 jenis sifat koligatif larutan. Melalui contoh soal dan pembahasan di atas, tentunya kamu akan lebih memahami rumus sifat koligatif larutan.

Koligatif Larutan Rumus (Δ Tp), (ΔTb), (Δ Tf ), (π), Soal dan Jawaban
S elain itu, rumus sifat koligatif larutan elektrolit dan nonelektrolit juga. Itu semua akan kita bahas di artikel selanjutnya, ya! Baca Juga: Proses Terjadinya Penurunan Tekanan Uap. Oke guys, setelah membaca artikel ini, kamu jadi tau ya apa itu larutan, pengertian sifat koligatif larutan, serta perbedaan larutan elektrolit dan nonelektrolit.

Detail Contoh Sifat Koligatif Larutan Koleksi Nomer 7
Berikut pengertian sifat koligatif larutan, manfaat sifat koligatif larutan, dan contoh soal sifat koligatif larutan dengan rekomendasi buku. Facebook;. tekanan osmotic merupakan larutan-larutan encer yang dapat dikalkulasikan dnegan rumus yang serupa dengan persamaan gas ideal berikut ini. PV = nRT atau П V = nRT. П = MRT. Keterangan : П.

SIFAT KOLIGATIF LARUTAN PART 2/ RUMUS SIFAT KOLIGATIF ELEKTROLIT DAN NONELEKTROLIT YouTube
100, 0128 ∘ C. 5. 100, 0234 ∘ C. Belajar Modul, Rumus, & Soal Sifat Koligatif Larutan dan kuis interaktif. Dapatkan Modul, Rumus, & Soal Sifat Koligatif Larutan lengkap di Wardaya College.

8 Rumus Sifat Koligatif Larutan Elektrolit dan Non Elektrolit Materi Kimia
1. Satuan Konsentrasi Larutan. Pembelajaran pertama yang harus kamu pahami adalah satuan konsentrasi larutan. Dalam materi ini, kamu akan mempelajari hal-hal yang digunakan untuk menganalisis sifat koligatif larutan yaitu molalitas, molaritas, & fraksi mol. Jika didefinisikan, molalitas adalah banyaknya mol zat pelarut yang ada dalam 1 kg.

SOLUTION Rumus sifat koligatif larutan kimia kelas xii 2021 Studypool
Berikut penjelasan kelompok sifat koligatif: 1. Koligatif Larutan - Penurunan tekanan uap jenuh (Δ Tp ) Penurunan tekanan uap jenuh adalah selisih tekanan uap pelarut murni dan tekanan uap larutan . tabel penurunan tekanan uap jenuh larutan non elektrolit dan elektrolit ↓. Uraian. Larutah non elektrolit.
The Chemsquad Headquarters Weapon 1 Sifat Koligatif Larutan
A. Pengertian Sifat Koligatif Larutan. Sifat koligatif larutan adalah sifat yang bergantung pada konsentrasi molekul atau ion zat terlarut, tetapi tidak bergantung pada jenis zat terlarutnya. Sifat koligatif meliputi empat hal yaitu: Penurunan Tekanan Uap. Penurunan Titik Beku. Kenaikan Titik Didih.

Soal dan Pembahasan SIFAT KOLIGATIF LARUTAN Kimia SMA kelas 12 YouTube
Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergatung pada jumlah zat terlarut yang larut pada suatu larutan. Sifat koligatif terdiri dari penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik. 1. Penurunan Tekanan Uap.

Rumus Sifat Koligatif Larutan Dan Contoh Soal Contoh Makalah
Sel Elektrolisis: Contoh Soal Reaksi Redoks dan Rumus Hukum Faraday | Kimia Kelas 12. Contoh Sel Volta: Leclanche, Baterai Perak Oksida, Merkurium, dan Proses Korosi | Kimia Kelas 12. Berikut ini rumus sifat koligatif larutan elektrolit, non-elektrolit, diagram P-T, molalitas, fraksi mol, tekanan uap jenuh, titik beku, titik didih, osmotik.

PPT SIFAT KOLIGATIF LARUTAN PowerPoint Presentation, free download ID4367326
Sifat Koligatif Larutan Elektrolit. Di konsenterasi yang sama, sifat koligatif larutan elektrolit memiliki jumlah nilai yang lebih besar dibandingkan sifat koligatif larutan non elektrolit, dan banyaknya partikel-partikel zat terlarut hasil dari reaksi ionisasi larutan elektrolit ini bisa dirumuskan didalam faktor Van't Hoff, untuk.