
Contoh Soal Perbandingan Kenaikan Titik Didih Larutan (Sifat Koligatif Larutan Elektrolit) YouTube
Ket: ΔT f = penurunan titik beku larutan (°C) m = molalitas (m) K f = tetapan penurunan titik beku molal (°C m-1) n = jumlah ion elektrolit α = derajat ionisasi/disosiasi. 3. Kenaikan Titik Didih (ΔT b). Sederhananya seperti ini. Saat zat pelarut (misalnya air) dipanaskan hingga menguap, partikel pelarut tersebut bergerak sangat cepat hingga berubah menjadi face gas.

CARA MENGHITUNG TITK DIDIH LARUTAN ELEKTROLIT YouTube
KOMPAS.com - Berikut cara menghitung kenaikan titik didih dan penurunan titik beku pada larutan elektrolit, serta cara menentukan faltor van't hoff larutan elektrolit:. Soal: Sebanyak 8,7 gram potassium sulfat (K2SO4) dilarutkan kedalam 250 gram air.Maka, kenaikan titik didihnya adalah… 0,312 derajat celcius; 0,624 derajat celcius; 1,312 derajat celcius.

Contoh Soal Kenaikan Titik Didih Larutan (Sifat Koligatif Larutan Elektrolit) YouTube
Jadi, ΔTb = 0,4 x molalitas = 80 - T. Di mana T adalah titik didih zat pada tekanan 1 atm. Dengan menggabungkan persamaan di atas, kita dapat menyelesaikan untuk T: T = 80 - 0,4 x molalitas. T = 80 - 0,4 x (1/0,2) T = 78 °C. Jadi, titik didih zat tersebut pada tekanan 1 atm adalah 78 °C. Jadi, titik didih adalah suhu di mana suatu zat.
Memahami Rumus Kenaikan Titik Didih Suatu Larutan Halaman 2 Nasional Katadata.co.id
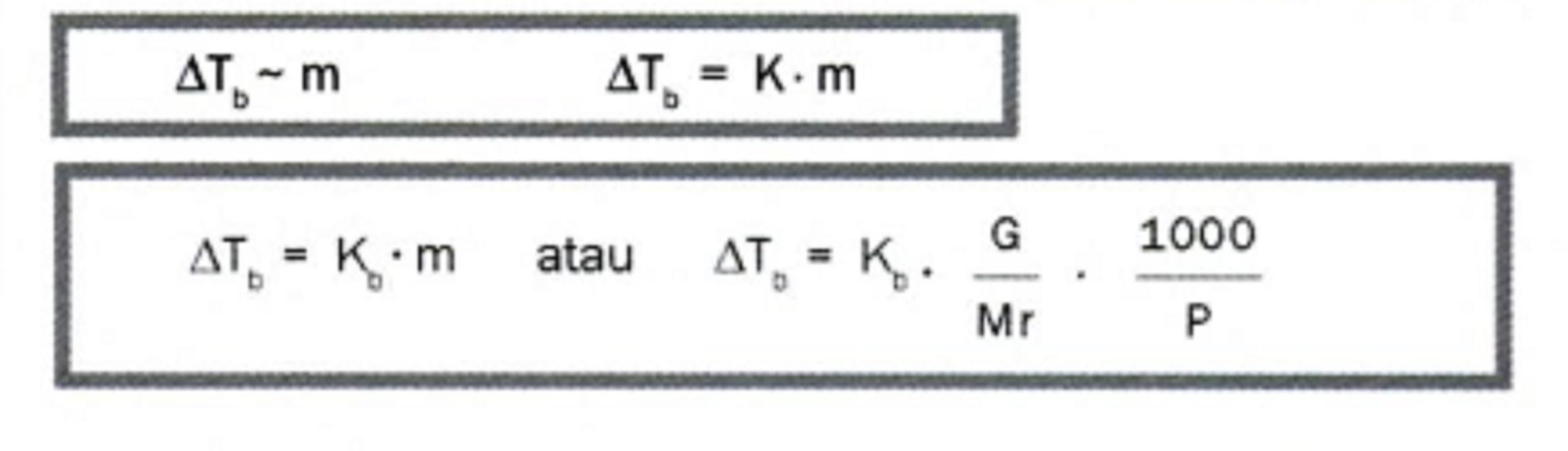
Untuk memudahkan kamu memahami rumus kenaikan titik didih, yuk perhatikan beberapa contoh soal beserta pembahasannya berikut ini.. ΔT b = K b. m = 0,52 °C molal-1 x 0,2 molal = 0,104 °C Jadi, kenaikan titik didih larutan gula tersebut adalah 0,104°C. Contoh Soal 2 Kenaikan Titik Didih. Suatu zat nonelektrolit yang massanya 3,42 gram.

Titik didih larutan elektrolit selalu lebih tinggi daripa...
Nilai dari sifat koligatif larutan non-elektrolit dapat diketahui dengan rumus-rumus berikut ini: Penurunan tekanan uap ΔP = P⁰. X𝗍 Ket: ΔP: penurunan tekanan uap larutan. ΔT𝖻: kenaikan titik didih larutan m: kemolalan (m) K𝖻: konstanta kenaikan titik didih molal pelarut (°C mol⁻¹) Tekanan osmotik π = M.R.T

Pengertian dan Rumus Kenaikan titik didih larutan
Kenaikan Titik Didih dan Penurunan Titik Beku Untuk memahami konsep kenaikan titik didih larutan kita akan contoh dalam kehidupan sehari-hari yakni apabila ke dalam air dilarutkan suatu zat tertentu, seperti yang kita ketahui akan terjadi penurunan tekanan uap larutan, sehingga pada suhu $\mbox{100}^{\circ}\mbox{C}$ larutan air belum mendidih.

Pengertian dan Rumus Kenaikan titik didih larutan
Itulah Rumus dan Contoh Soal Penurunan Tekanan Uap Jenuh, Kenaikan Titik Didih, dan Penurunan Titik Beku Larutan Elektrolit yang dapat kami bagikana pada kesempatan kali ini, semoga dapat memberikan manfaat dan dimanfaat dalam pengembangan ilmu pengetahuan Kimia. - RumusKimia.net

Konsep Mudah Menentukan Titik Didih, Titik Beku Dan Tekanan Osmotik Larutan Elektrolit KIMIA
Pembahasan. Kenaikan titik didih larutan dirumuskan Raoult sebagai. Larutan non elektrolit. Larutan non elektrolit. Harga tetapan kenaikan titik didih molal (Kb) tergantung pada jenis pelarut yang digunakan. Berdasarkan rumus di atas, maka kenaikan titik didih larutan bergantung pada: konsentrasi zat terlarut dan derajat ionisasinya.

PPT SIFAT KOLIGATIF LARUTAN PowerPoint Presentation, free download ID4367330
Sifat koligatif sendiri hanya memandang "kuantitas", bukan "kualitas". Oleh sebab itu, sifat larutan, seperti rasa, warna, dan kekentalan (viskositas) merupakan sifat-sifat yang bergantung pada jenis zat terlarut yang tercampur dalam larutan. Terdapat empat sifat koligatif larutan, yaitu penurunan tekanan upa, kenaikan titik didih.

Cara Menghitung Kenaikan Titik Didih Pada Larutan Elektrolit Reverasite
Kenaikan titik didih larutan elektrolit. Cara mencari kenaikan titik didih larutan elektrolit menggunakan rumus dibawah ini: ΔT b = m . K b. {1 + (n - 1)α} Keterangan: n = jumlah ion; α = derajat ionisasi; Contoh soal dan pembahasan. Contoh soal 1. Sebanyak 36 gram glukosa (Mr = 180) dilarutkan dalam 250 mL air. Bila Kb air = 0,52 °C/m.

Rumus Dan Contoh Soal Kenaikan Titik Didih Larutan Elektrolit Dan Non Reverasite
Tabel Tetapan Kenaikan Titik Didih (Kb) Beberapa Pelarut. Pelarut Titik Didih Tetapan (Kb) Aseton: 56,2 1,71 Benzena: 80,1 02,53. sifat koligatif larutan elektrolit memliki nilai yang lebih besar daripada sifat koligatif larutan non elektrolit.. Rumus penurunan tekanan uap jenuh dengan memakai faktor Van't Hoff adalah:

Rumus Dan Contoh Soal Kenaikan Titik Didih Larutan Elektrolit Dan Non Riset
Perubahan dari titik didih air menjadi titik didih campuran inilah yang disebut dengan kenaikan titik didih. Kenaikan titik didih memiliki rumus sebagai berikut : ΔTb : Tb Larutan-Tb Pelarut. Dengan keterangan :. (untuk larutan elektrolit kuat secara umum nilainya dianggap = 1) Tabel Konstanta Didih Setiap Benda. Pelarut: Titik Didih (o C.
Video belajar Soal Kenaikan Titik Didih pada Larutan Elektrolit 2 Kimia untuk Kelas 12
Selisih antara titik didih larutan dengan titik didih pelarut inilah yang disebut dengan kenaikan titik didih ( ∆T b ). Rumus untuk menentukan kenaikan titik didih ( ∆T b ) adalah: Untuk larutan yang bersifat elektrolit, maka persamaannya akan berubah menjadi: T b = K b . m [ 1 + ( n - 1 ) α ]

kenaikan titik didih(penjelasan di deskripsi) YouTube
Video ini berisi penjelasan materi tentang salah satu sifat koligatif larutan, yaitu kenaikan titik didih. Untuk mempermudah pemahaman, video ini dilengkapi.

Video Belajar Soal Kenaikan Titik Didih Pada Larutan Elektrolit Kimia My XXX Hot Girl
B. Rumus Kenaikan Titik Didih. Keterangan : Tb larutan = titik didih larutan. Tb pelarut murni = titik didih pelarut. ∆Tb = kenaikan titik didih. Kenaikan titik didih larutan merupakan salah satu sifat koligatif larutan. Untuk menghitung perubahan titik didih larutan non-elektrolit atau larutan yang encer, maka kita bisa menggunakan persamaan.

Penurunan Titik Beku Larutan Elektrolit Reverasite
Rumus ini menghubungkan kenaikan titik didih (ΔTb), molalitas (m), konstanta ebullioskopik (Kb), dan faktor van't Hoff (i) dari zat terlarut dalam larutan. Perhatikan bahwa dalam kasus senyawa kovalen atau molekul non-elektrolit, nilai faktor van't Hoff (i) biasanya adalah 1, karena senyawa ini tidak mengionisasi dalam larutan.