PPT ASAM BASA PowerPoint Presentation, free download ID3918892
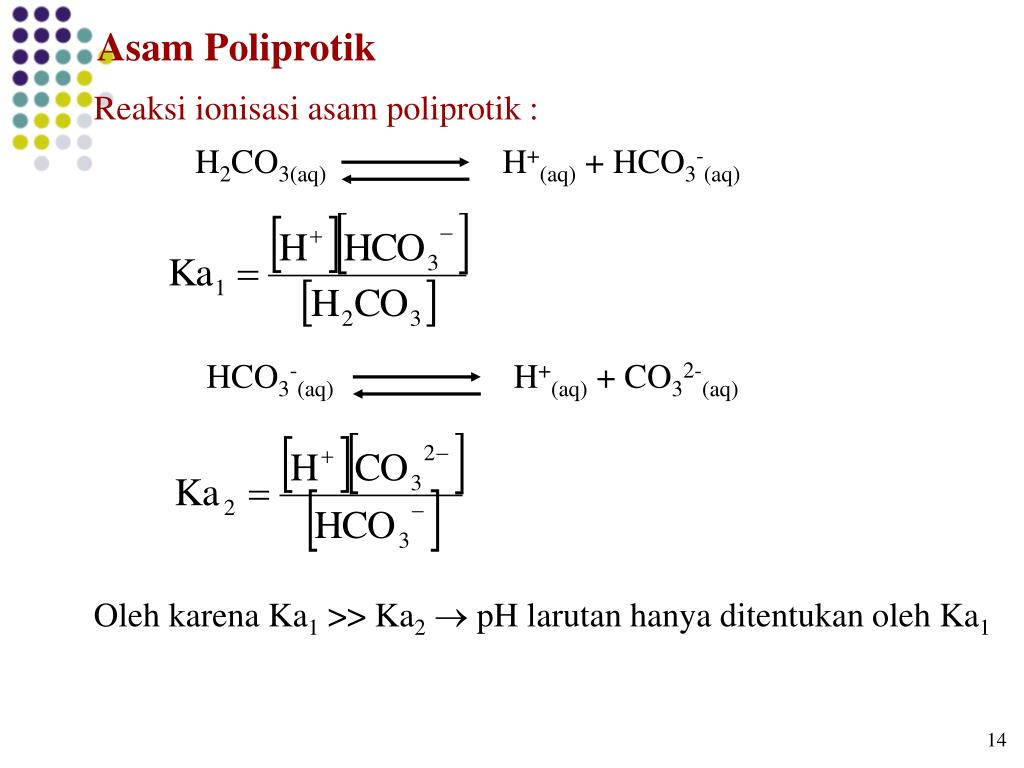
The buffer capacity b V is an intensive property, expressed in terms of molar concentrations, i.e., intensive variable. The expressions for dV dpH in Eq. 3 will be formulated below. 3 Formulation of Dynamic Buffer Capacity Some particular systems can be distinguished. For the sake of simplicity in notation, the charges of particular species Xz i
PPT GARAM TERHIDROLISIS DAN LARUTAN BUFFER PowerPoint Presentation, free download ID6100533
Pembahasan materi Prinsip Kerja Buffer dan Kapasitas Buffer dari Kimia untuk SD, SMP, SMA, dan Gap Year beserta contoh soal latihan dan video pembahasan terlengkap. Belajar. Kelas 11 - Kimia. Larutan Buffer K 13 RK 11 Kumer Fase F. Prinsip Kerja Buffer Dan Kapasitas - 05 Kapasitas Buffer Part 2.

Inilah Contoh Soal Menghitung Ph Larutan Buffer Terbaru Daftar Contoh Soal 2022
Definition of Dynamic Buffer Capacity. In this work, the buffer capacity is defined as follows: β V = d c dpH. 1. where. c = C · V V 0 + V ≡ C - C · V 0 V 0 + V. 2. denotes the current concentration of a reagent R in a D + T mixture obtained after addition of V mL of C mol·L −1 solution of the reagent R (considered as titrant, T) into.

Perhitungan pH Buffer dan Kapasitas Buffer YouTube
Kami akan mendapatkan rumus yang menghubungkan kapasitas buffer dengan pH, pKa, dan konsentrasi buffer. Perhitungan Kapasitas Buffer. Sekarang setelah kita telah mengamati bagaimana persamaan buffer dapat ditulis, mari kita coba turunkan untuk memahami lebih baik bagaimana kita sampai pada persamaan yang disebutkan di atas. Untuk.

PPT PEMBENTUKAN LARUTAN dan KONSENTRASI LARUTAN PowerPoint Presentation ID5586096
Cara Menghitung Kapasitas Penyangga. LANGKAH 1: Ambil 1 dm 3 buffer of interest (1 Liter) LANGKAH 2: Ukur pH awal dengan menggunakan pH meter yang dikalibrasi secara akurat, pH x . LANGKAH 3: Tambahkan sejumlah asam kuat / basa kuat dan campur larutan dengan baik agar seimbang.

Penjelasan Rumus Buffer ( Rumus, Soal & Contoh )
into buffer solution to get a final concentration of 0.02 gram-equivalent/liter. The concentrations of Na 2 HPO 4 and NaH 2 PO 4 in the solutions were similar to those of original buffer, i.e., 0.002 M Na 2 HPO 4 and 0.001 M NaH 2 PO 4. During titration of these solutions into an original buffer, the concentration of HCl or NaOH gradually.

PPT KESETIMBANGAN ASAMBASA PowerPoint Presentation, free download ID4181029
Introduction. In agricultural areas, riparian buffer strips (RBSs) are bands of planted or indigenous vegetation located at a prescribed distance from the banks of a stream (or watercourse) for the purpose of filtering nutrients, sediments and other contaminants from upland agricultural runoff (Nieswand et al. Citation 1990; Gumiere et al. Citation 2011).

PPT GARAM TERHIDROLISIS DAN LARUTAN BUFFER PowerPoint Presentation, free download ID6100533
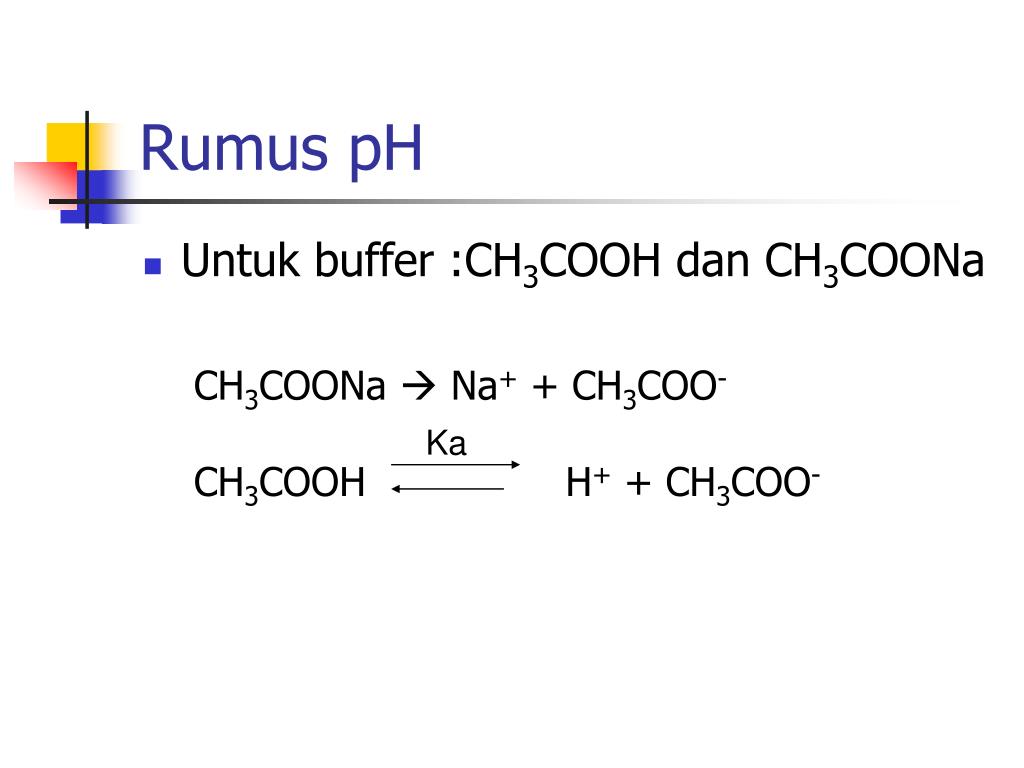
Setelah diketahui konsentrasi H +, maka pH dapat dihitung dengan rumus:. pH = - log [H +] = - log (2.478 x 10-4) = 3.605. Jadi pH larutan buffer yang dibuat dari 0.7 M asam format dan 0.5 M natrium format yaitu sebesar 3.605.
Buffers
Jurnal Larutan Penyangga/Buffer [PDF] No. 1-6 1. Analisis Miskonsepsi Siswa SMA Pada Pembelajaran Kimia untuk Materi Larutan Penyangga DOWNLOAD 2. Pembelajaran Direct Instruction Disertai Hierarki Konsep untuk Mereduksi Miskonsepsi Siswa Pada Materi Larutan Penyangga Kelas XI IPA Semester Genap SMA Negeri 2 Sragen Tahun Ajaran 2012/2013 DOWNLOAD 3.

PPT SISTEM BUFFER ASAM BASA PowerPoint Presentation, free download ID6420439
Kapasitas buffer juga dapat diartikan sebagai jumlah mol basa kuat yang dibutuhkan untuk mengubah pH 1 L larutan sebesar 1 pH satuan.. Larutan Buffer : Pengertian - Fungsi - Rumus - Contoh Soal. 2 Contoh Larutan Penyangga Asam. 2 Contoh Larutan Penyangga Basa. 4 Faktor yang Mempengaruhi pH Air dan Contohnya.
Larutan dapar pH dan kapasitas dapar part 1 YouTube
Anna Maria Michałowska-Kaczmarczyk, Tadeusz Michałowski, Agustin G. Asuero. Formulation of Dynamic Buffer Capacity for Phytic Acid. American Journal of Chemistry and Applications. Vol. 2, No. 1, 2015, pp. 5-9. Abstract The general formulation of dynamic buffer capacity for polyprotic acids and bases (and polyprotic acid and base salts) has

Kapasitas larutan Buffer YouTube
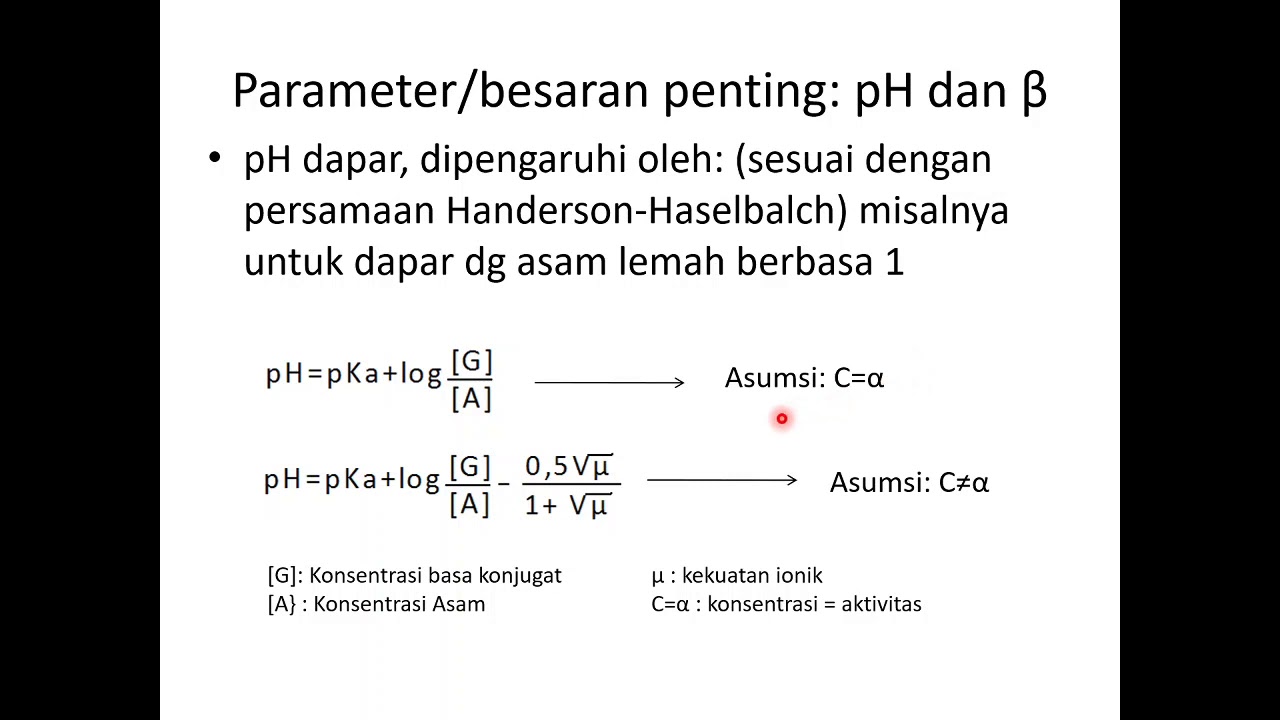
Kapasitas bufer (𝛽) dapat didefinisikan sebagai jumlah asam kuat atau basa kuat yang ditambahkan ke dalam 1 liter larutan penyangga yang menyebabkan perubahan pH sebesar 1 satuan: β = Δcb ΔpH = − Δca ΔpH. atau dapat menyesuaikan dengan data yang diketahui dihitung dengan menggunakan persamaan Van Slyke: β = 2, 303 × (ca +cb).Ka.

Dapar dan larutan 2
By the way of example, a 0.1 M solution of a strong acid (e.g., HCl) has pH = 1 and buffer capacity equal to its concentration multiplied by 2.3, i.e., η = 0.23 M. Suppose that, by adding NaOH, we want to increase the pH of the 0.1 M HCl solution of one unity so that the final pH is two.A misinterpretation of definition (1) would convey the idea that we should add NaOH so that ΔC NaOH = η.

(DOC) RUMUS KIMIA BUFFER Prita Sari Academia.edu
Buffer Capacity. Buffers are characterized by the pH range over which they can maintain a more or less constant pH and by their buffer capacity, the amount of strong acid or base that can be absorbed before the pH changes significantly. Although the useful pH range of a buffer depends strongly on the chemical properties of the weak acid and.

FARMASI FISIKA Perhitungan Kapasitas Dapar YouTube
NH4 + OH- = NH4OH Rumus untuk menghitung besarnya kapasitas buffer ∆𝐵 B= ∆𝑝𝐻 Dimana ∆B adalah sedikit penambahn basa kuat ke dalam larutan buffer hingga menghasilkan perubahan pH = ∆pH. ∆pH adalah perubahan pH akibat penambahan sejumlah B reagents.

Menghitung pH buffer setelah penambahan Asam dan Basa YouTube
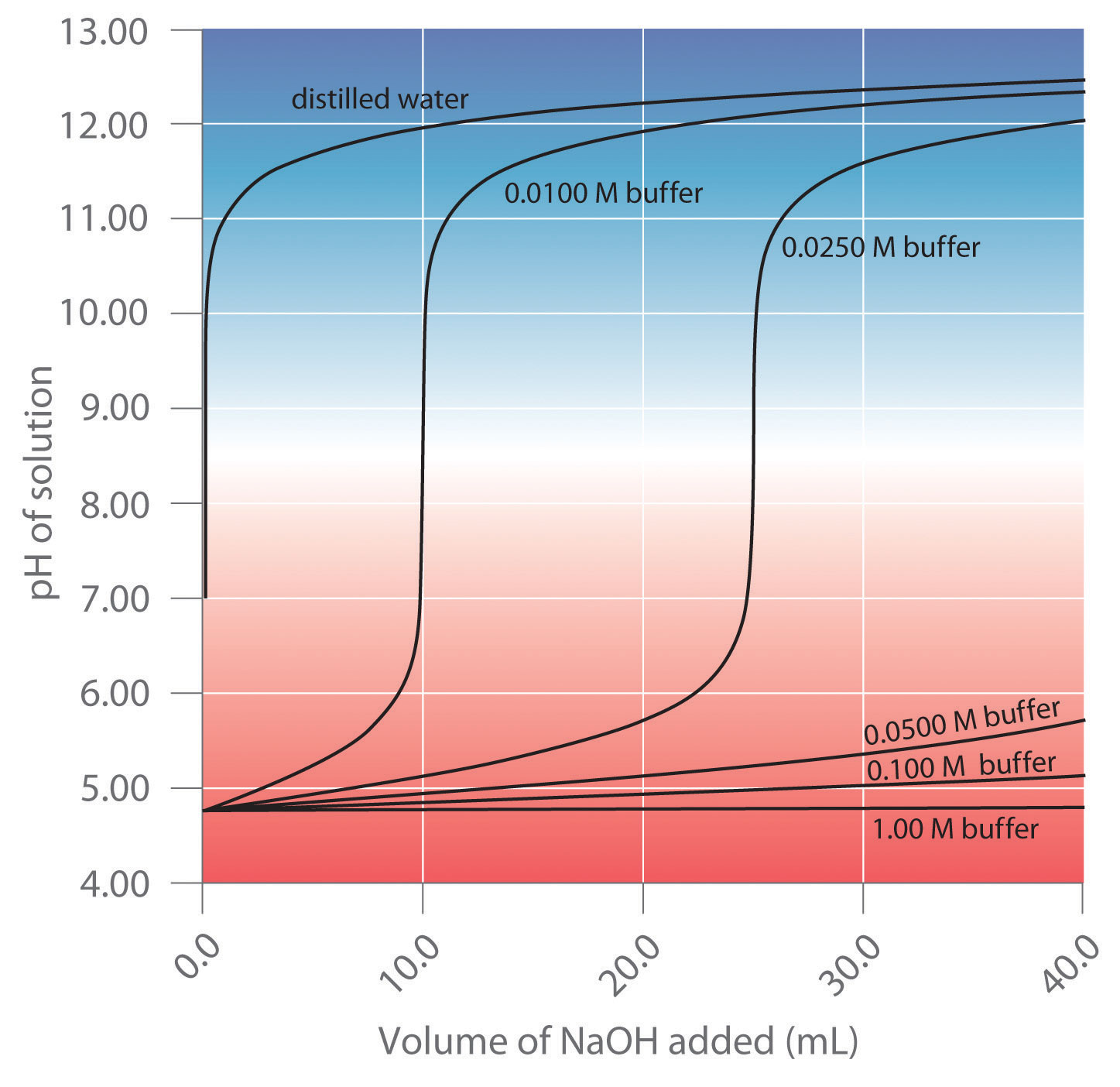
Figure 5.14.1 5.14. 1: Effect of Buffer Concentration on the Capacity of a Buffer. A buffer maintains a relatively constant pH when acid or base is added to a solution. The addition of even tiny volumes of 0.10 M NaOH N a O H to 100.0 mL of distilled water results in a very large change in pH. As the concentration of a 50:50 mixture of sodium.