
Hitunglah jumlah partikel zat berikut! YouTube
Jawab: a) Gas O2 adalah unsur diatomik dengan partikel berupa molekul unsur. b) Banyaknya mol O2 yang mengandung 1,505 × 1023 partikel dapat kita hitung dengan menggunakan rumus berikut. Jumlah partikel = mol × N. mol = Jumlah partikel/N. mol = 1,505 × 1023/6,02 × 1023. mol =1,505/6,02. mol = 0,25 mol.

PPT KONSEP MOL PowerPoint Presentation, free download ID6336687
Koefisien merupakan bentuk perbandingan mol, volume, atau jumlah partikel. Adapun rumus-rumus yang biasa digunakan dalam menyelesaikan stoikiometri adalah sebagai berikut. Pengertian Pereaksi Pembatas. Membahas reaksi kimia, sama artinya membahas zat pereaksi dan produk hasil reaksi. Zat pereaksi biasanya ditulis di ruas kiri, sedangkan produk.

Menghitung Jumlah Partikel Zat YouTube
Hubungan Mol dengan Jumlah Partikel, Massa Zat, Volume Zat, Rumus dan Contoh Penyelesaian Mol - Sahabat tentu pernah mendengar satuan dosin, gros, rim, atau kodi untuk menyatakan jumlah benda. Banyaknya partikel dinyatakan dalam satuan mol. Satuan mol sekarang dinyatakan sebagai jumlah partikel (atom, molekul, atau ion) dalam suatu zat. Para.

Hubungan Mol Jumlah Partikel Massa Volume (STP) YouTube
Belajar Modul, Rumus, & Soal Partikel Dasar Atom dan kuis interaktif. Dapatkan Modul, Rumus, & Soal Partikel Dasar Atom lengkap di Wardaya College.. Nukleon, yakni partikel yang terdapat di dalam nukleus/inti atom, terdiri dari neutron dan proton. Jumlah nukleon di dalam suatu atom menentukan massa atom tersebut, yang sering juga disebut.

Tutorial Teori Gas Menghitung Jumlah Partikel YouTube
Para ahli sepakat bahwa satu mol zat mengandung jumlah partikel yang sama dengan jumlah partikel dalam 12,0 gram isotop C-12 yakni 6,02 x 1023 partikel.. (Am-bient Temperature and Pressure) atau lebih dikenal keadaan non-STP maka menggunakan rumus: P V = n R T P = tekanan, satuan P adalah atmosfer (atm) V = volume, satuan Vadalah liter n.
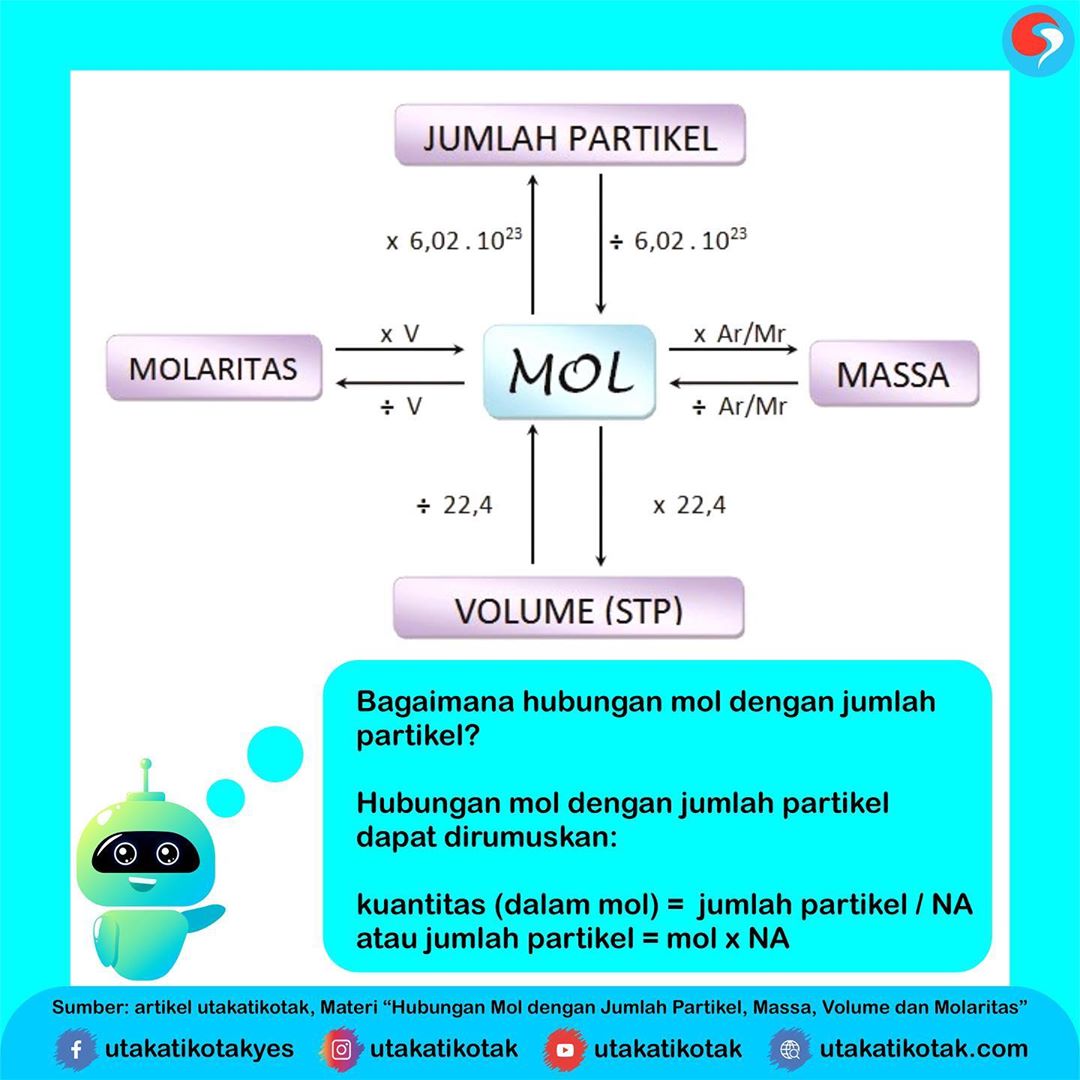
Hubungan Mol dengan Jumlah Partikel, Massa, Vo
Dapatkan Modul, Rumus, & Soal Konsep Mol lengkap di Wardaya College.. Konsep mol adalah Ide atau pengertian mengenai mol, yakni satuan jumlah suatu zat.. Banyaknya atom atau partikel yang terdapat dalam 12 gram C-12 adalah $6,02\times10^{23}$ partikel yang disebut dengan tetapan Avogadro yang dinyatakan dengan simbol L atau NA.

Partikel Bermuatan Positif Yang Terdapat Dalam Inti Atom Adalah kabarmedia.github.io
Senyawa kimia identik dengan rumus-rumus kimia yang dinyatakan dengan unsur-unsur tertentu, contohnya air (H 2 O), oksigen. Satu mol menunjukkan banyaknya partikel yang terkandung dalam suatu zat yang jumlahnya sama dengan jumlah partikel dalam 12 gram atom C-12. Memang, ada berapa sih partikel dalam 12 gram atom C-12?.

Konsep Mol Kimia Kelas 10 • Part 1 Hubungan Mol & Massa, Jumlah Partikel, Volume Gas, Molaritas
Definisi mol pada era modern akan dibahas lebih dalam pada materi konsep mol. Pada dasarnya mol menjembatani antara jumlah partikel yang digambarkan oleh bilangan Avogadro (berapa jumlah partikel yang dikandung zat setiap mol nya) serta massa suatu zat yang dilambangkan oleh massa molar (berapa gram yang dikandung suatu zat setiap mol nya).. Massa molear ini juga sering disebut massa atom.

Soal Konsep Mol Bilangan Avogadro = 6,02 x 10^23 maka 0,5 mol air mengandung Berapa Molekul
Rumus mol berdasarkan jumlah partikel. Rumus mol yang pertama adalah yang dikemukakan oleh Amedeo Avogadro dalam hukum Avogradro. Dilansir dari Encyclopedia Britannica, menurut Avogadro jumlah partikel dalam satu mol adalah sama untuk semua zat. Artinya, jumlah partikel dalam zatu mol zat akan sama dengan jumlah partikel dalam samu mol zat lainnya.

Rumus Jumlah Partikel
satuan mol dengan jumlah partikel: n = jumlah partikel 6,02 ×1023. Jumlah partikel =n × 6,02 ×1023. Soal-1. Dalam 0,1 mol H 2 SO 4, tentukan: a. jumlah partikel H 2 SO 4. b. jumlah atom H, S, dan O. c. jumlah ion H + dan ion SO 42-. Klik untuk melihat bahasan soal ini.

Tentukan jumlah partikel proton, neutron, dan elektron su...
Hubungan antara jumlah mol dan jumlah partikel adalah : Jumlah mol = jumlah partikel / L Jumlah Partikel (molekul) = jumlah mol x L Dengan L = bilangan avogadro = 6,02 x 10 pangkat 23 partikel/mol. Contoh soal: Berapa jumlah mol amonia (NH3) yang terdapat dalam 3,01 x 1026 molekul NH3 ? Jawaban: Jumlah mol = 3,01 x 1026 / 6,02 x 1023 = 500 mol; 2.

JUMLAH PARTIKEL YouTube
Hubungan Mol dengan Jumlah Partikel. Seperti yang udah kalian tahu nih, 1 mol menyatakan banyaknya partikel dalam suatu zat, yang mana jumlahnya sama dengan jumlah partikel dalam 12 g atom C-12. Berdasarkan penelitian pak Avogadro diketahui nih kalau dalam 1 mol atau 12 g atom C-12 terkandung 6,02 x 10²³ partikel.
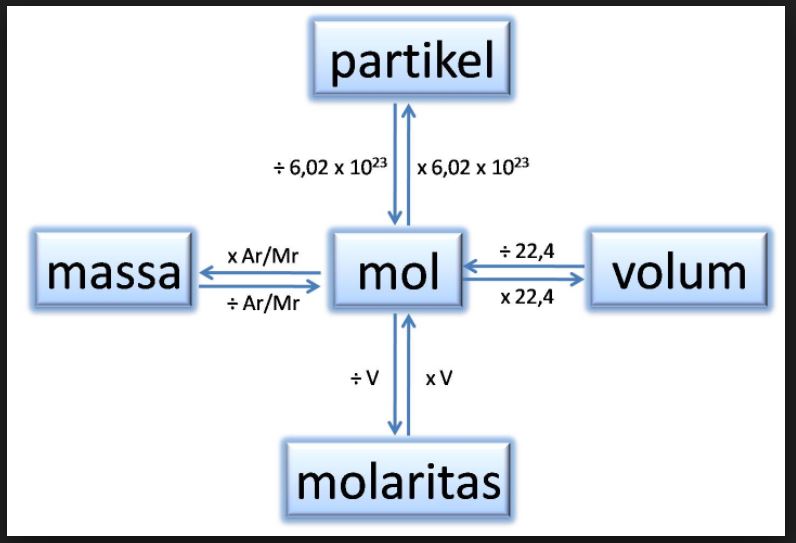
Hubungan Mol dengan Jumlah Partikel dan Massa Zat cekrisna
Contoh Penggunaan Rumus untuk Menghitung Jumlah Partikel Contoh penggunaan rumus ini adalah dalam menghitung jumlah molekul air dalam 1 liter air. Kita dapat menghitung berapa mol air yang terkandung dalam 1 liter air, yaitu sekitar 55,5 mol. Dengan menggunakan rumus di atas, kita dapat mengalikan jumlah mol dengan bilangan Avogadro untuk.

Rumus Jumlah Partikel
Video ini berisi penjelasan tentang konsep mol dan jumlah partikel yang dilengkapi dengan contoh-contoh soal.Open private class/kelompok belajar kimia SMA da.

Tentukan jumlah partikel (atom atau molekul) yang terdapat dalam a. 2 mol NH3 b. 1 mol Ca YouTube
Rumus yang digunakan adalah: Jumlah partikel atom = jumlah mol x bilangan Avogadro. Contohnya, jika kita memiliki 2 mol atom hidrogen (H2), maka jumlah partikel atomnya adalah: Jumlah partikel atom = 2 mol x 6,022 x 10^23 partikel/mol. Dalam contoh di atas, jumlah partikel atom dalam 2 mol atom hidrogen adalah sebanyak 1,2044 x 10^24 partikel atom.
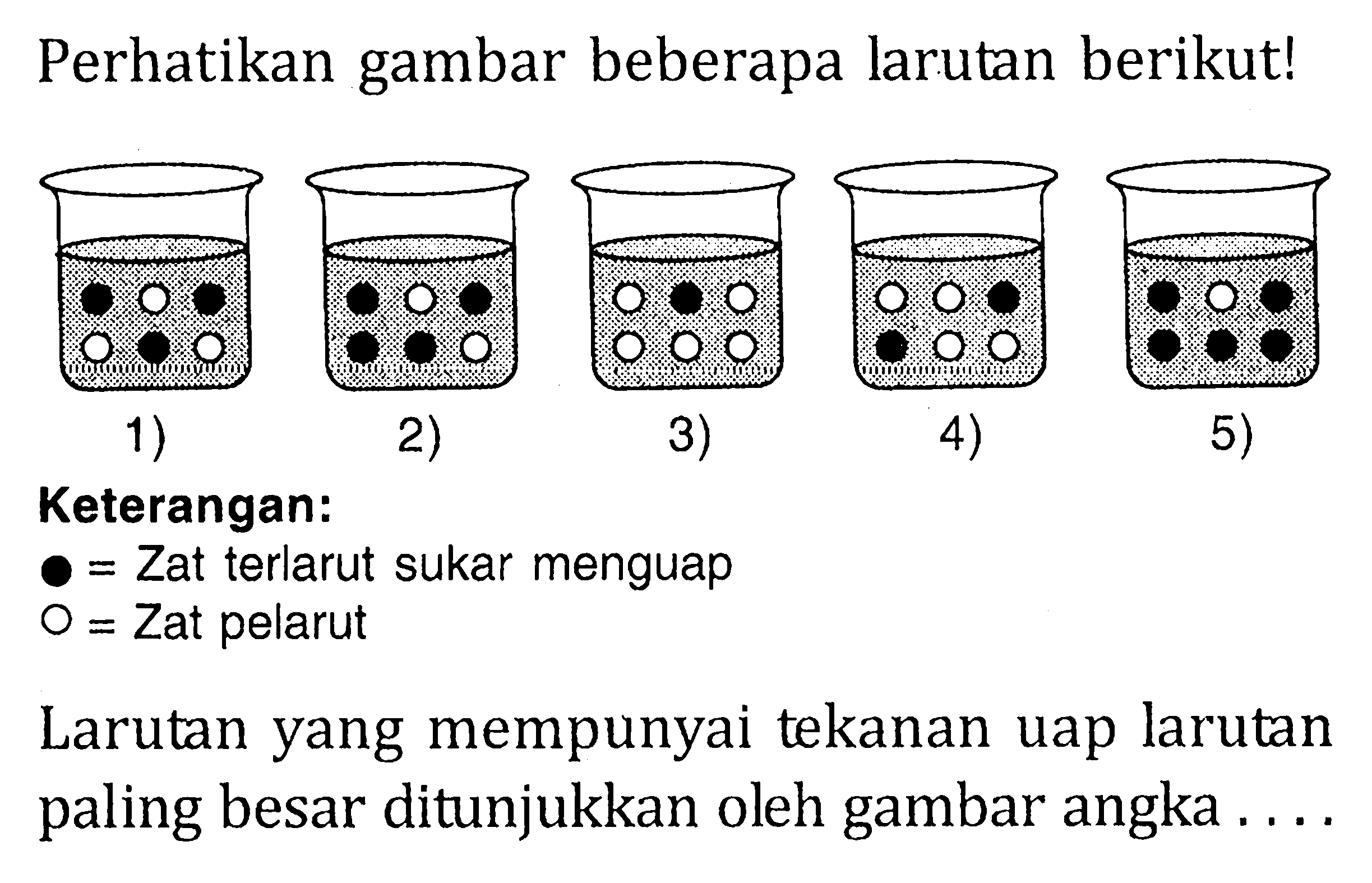
Perhatikan grafik berikut! Jika jumlah mol partikel pelar...
Dalam rumus ini, N adalah jumlah partikel, n adalah jumlah mol, dan NA adalah konstanta Avogadro. 3. Hitung hasilnya. Dengan mengalikan jumlah mol dengan konstanta Avogadro, Anda akan mendapatkan jumlah partikel yang diinginkan. Pastikan untuk menggunakan unit yang benar, seperti atom atau mol, sesuai dengan jenis partikel yang dihitung.