
Reaksi yang dapat berlangsung spontan atau tidak berdasarkan Potensial reduksiE°sel kimia YouTube
9 Oktober 2023. jelaskan yang dimaksud dengan reaksi spontan -. Reaksi spontan adalah reaksi kimia yang terjadi secara alami tanpa bantuan energi luar. Reaksi ini berlangsung begitu cepat hingga tidak dapat dicegah atau dikendalikan. Secara umum, reaksi spontan menghasilkan produk dan energi yang berbeda dari bahan baku.

Reaksi Redoks Spontan Reaksi redoks spontan adalah reaksi
10. Periksa reaksi berikut ini. F2 + 2Cl- → Cl2 + 2F-Dik Eo F2 = +2,87 V Eo Cl2 = +1,36 Apakah reaksi ditatas dapat berlangsung spontan ? Jika bisa tentukan besar potensial elektroda yang dihasilkan dari reaksi diatas ! Jawab : Sekali lagi, kita gunakan rumus sebelumnya untuk menentukan suatu reaksi dapat berlangsung spontan atau tidak.

un sma 2017 kimia , no 33, reaksi spontan sel volta YouTube
LAPORAN PRAKTIKUM REAKSI SPONTAN DAN POTENSIAL REDUKSI Nama : Januar Dwiyuwana Putra Kelas : XII IPA 2 Kelompok : Piket Selasa SMAN 3 KOTA TANGERANG TAHUN 2018 A. Tujuan Percobaan : Menyelidiki reaksi spontan (berlangsung) B. Teori Penunjang Konsep reduksi dan oksidasi (redoks) berdasarkan pengikatan dan pelepasan oksigen, penyerahan dan penerimaan elektron, serta peningkatan dan penurunan.

BAHAN PELAJARAN MAPEL KIMIA BAB 2 REAKSI REDOKS DAN ELEKTROKIMIA
Suatu reaksi redoks akan berlangsung spontan ke arah pembentukan produk bila potensial reaksinya bernilai positif. Redoks spontan: E° redoks > 0. Deret Keaktifan Logam (Deret Volta) Urutan unsur-unsur logam pada tabel potensial elektrode standar disebut juga deret elektrokimia (deret volta). Deret ini memberikan informasi reaktivitas unsur.

PPT Reaksi Redoks Spontan PowerPoint Presentation, free download ID2077169
Reaksi tidak spontan merupakan reaksi yang tidak dapat berlangsung pada kondisi standar. Reaksi tidak spontan ini ditandai dengan nilai potensial sel yang bernilai negatif. Untuk memprediksi reaksi berlangsung spontan atau tidak bisa menggunakan dua cara, yaitu cara perhitungan sampai menghasilkan potensial sel dan cara menggunakan deret volta.
PPT Energi, Entropi & Spontanitas Reaksi PowerPoint Presentation ID5926663
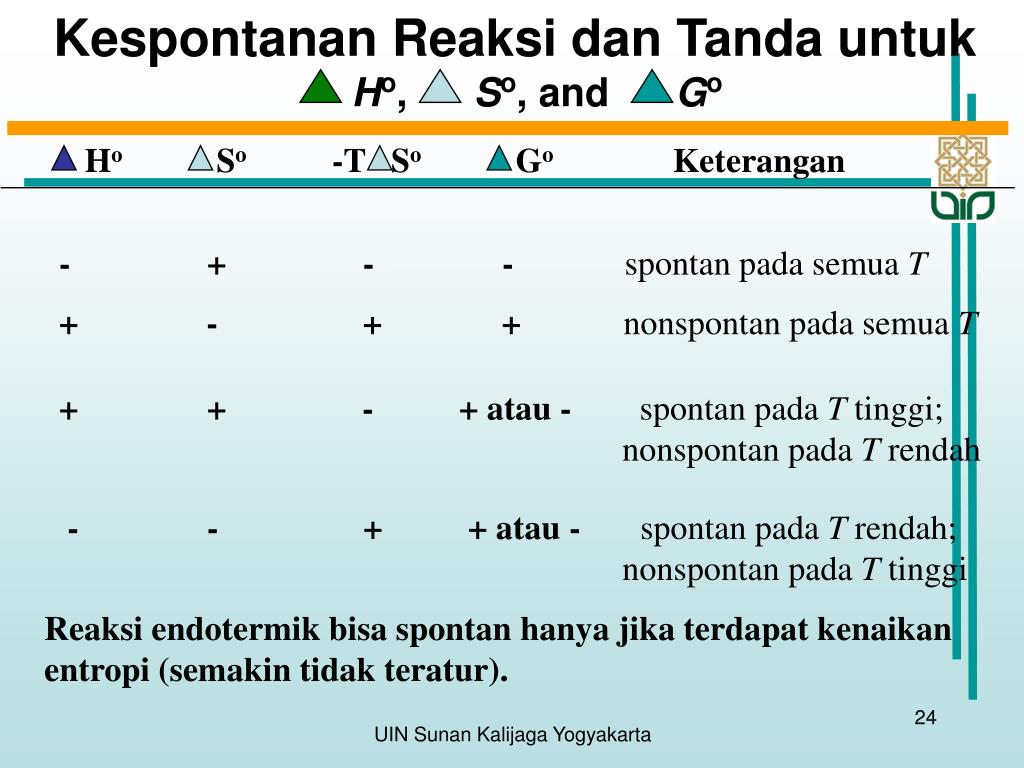
Bila suatu proses eksotermik berlangsung dalam suatu sistem, kalor yang dipindahkan ke lingkungan meningkatkan gerakan molekul di lingkungan.. {0 Reaksi spontan ke arah kedepan}\\ \triangle G & >\mbox{0 Reaksi nonspontan. Reaksi ini spontan pada arah yang berlawanan}\\ \triangle G & =0\mbox{ Sistem bereda pada kesetimbangan} \end{aligned} $.

Cara cepat menentukan reaksi yang berlangsung spontan atau tidak menggunakan e°sel YouTube
Reaksi berlangsung spontan merupakan reaksi kimia yang terjadi dengan sendirinya tanpa adanya intervensi atau pengaruh dari faktor eksternal. Reaksi ini berlangsung berdasarkan perubahan energi bebas (Gibbs) yang negatif, yang mengindikasikan bahwa energi produk lebih rendah daripada energi reaktan. Ada beberapa faktor yang mempengaruhi reaksi.

Berdasarkan deret volta, tentukan reaksi yang berlangsung...
Reaksi spontan berlangsung sendiri di bawah serangkaian kondisi tertentu. Namun, energi harus disediakan untuk reaksi nont spontan untuk melanjutkan. Perubahan energi bebas Gibbs negatif untuk reaksi spontan. Karena itu, reaksi-reaksi ini melepaskan energi ke lingkungan dalam bentuk panas. Dalam reaksi yang tidak spontan, perubahan energi bebas.

Sel Voltasoal reaksi yang berlangsung spontan atau tidak spontan kimia SMA YouTube
Kontrol reaksi: Karena reaksi yang berlangsung tidak spontan memerlukan energi eksternal atau adanya faktor-faktor tertentu untuk terjadi, Anda dapat mengontrol reaksi tersebut sesuai kebutuhan. Keamanan: Beberapa reaksi yang berlangsung tak spontan melibatkan senyawa berbahaya atau reaktan yang mudah terbakar.

Reaksi elektrokimia berikut yang dapat berlangsung secara...
Nilai potensial standar ini menunjukkan 3 ciri pada sel volta: Tegangan yang dihasilkan oleh sel volta; Jika nilai E 0 sel > 0 (+) maka reaksi sel spontan (berlangsung); Jika nilai E 0 sel < 0 (-) maka reaksi sel tidak spontan (tidak berlangsung); Reaksi Sel tidak spontanmenunjukkan tidak terjadinya suatu reaksi pada sel volta.Hal ini disebabkan karena penempatan anoda dan katoda tidak mengacu.

Reaksi Redoks Spontan Reaksi redoks spontan adalah reaksi
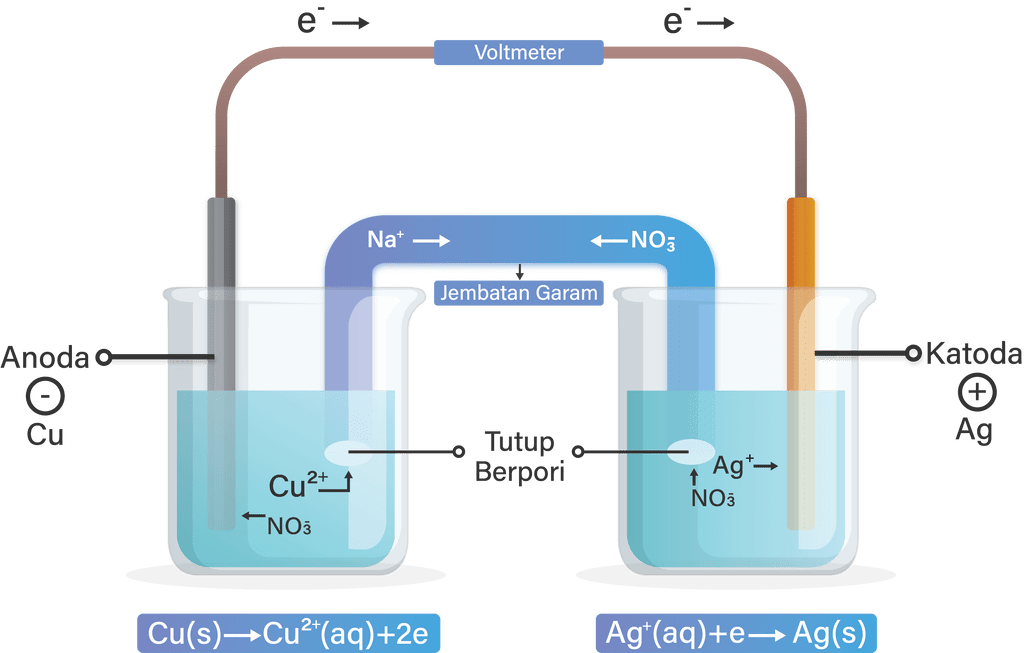
Oleh karena itu, reaksi redoks yang berlangsung spontan inilah yang disebut sebagai sel volta. Setelah penjabaran tersebut, apa fungsi sel volta yang elo udah mulai ngeh? Intinya, sel volta ini berfungsi untuk menghasilkan arus listrik, dan mekanisme inilah yang digunakan dalam prinsip pembuatan baterai yang sehari-hari kita pakai..

Reaksi Redoks yang Berlangsung Spontan YouTube
Potensial reaksi redoks ini digunakan untuk meramalkan apakah suatu reaksi berlangsung spontan atau tidak. a. Bila positif, maka reaksi akan terjadi spontan. b. Bila negatif, maka reaksi tidak akan terjadi spontan. Contoh: Diketahui data potensial elektrode sebagai berikut:
Reaksi spontan berikut terjadi saat logam Cu dimas...
Diantara pernyataan berikut ini manakah pernyat. 1. Diantara pernyataan berikut ini manakah pernyataan yang tidak benar. Select one: a. Jika ∆H < 0 dan ∆S > 0 maka reaksi berlangsung spontan pada suhu tinggi saja b. Jika ∆H > 0 dan ∆S > 0 maka reaksi berlangsung tidak spontan pada suhu rendah saja c. Jika ∆H < 0 dan ∆S < 0 maka.
Reaksi Redoks Spontan Reaksi redoks spontan adalah reaksi
Gambar 01: Perbandingan Reaksi spontan dan non-spontan. Jadi, kita harus menyediakan beberapa faktor eksternal agar reaksi ini dapat berkembang. Contoh: kami dapat menyediakan panas, memberikan tekanan, menambahkan katalis, dll. Selain itu, energi bebas Gibbs positif untuk reaksi ini.

Reaksi Spontan (Sel Elektrokimia) KIMIA SMA YouTube
Mencari reaksi yang dapat berlangsung spontan atau tidak spontan berdasarkan Potensial reduksi E°sel yang diketahui pada reaksi. Cara mudah belajar kimia sma.

Reaksi berikut yang tidak berlangsung spontan adalah....
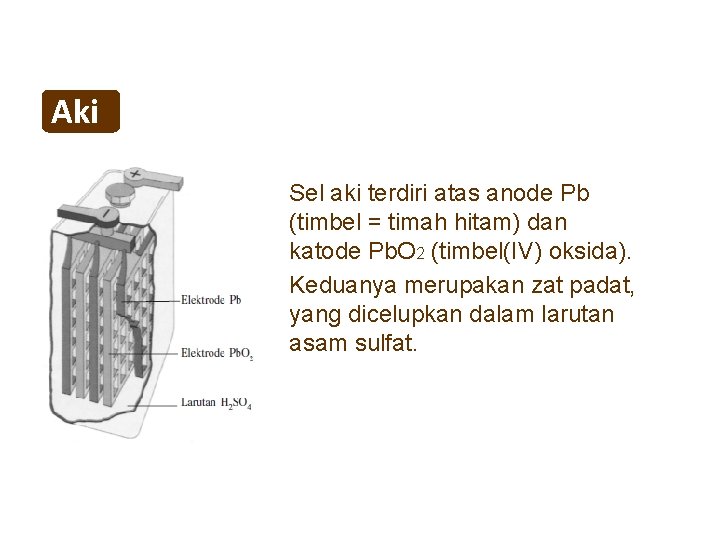
Sel volta merupakan sel elektrokimia, yang dapat mengubah reaksi kimia dari reaksi redoks spontan (reaksi yang dapat berlangsung dengan sendirinya). Reaksi redoks spontan dapat diubah, untuk digunakan sebagai sumber listrik.. Unsur E° akan lebih besar pada reaksi reduksi di katoda, sedangkan pada reaksi oksidasi di anoda, unsur E° reduksi.