
Perhatikan kurva titrasi larutan asam asetat dengan larut...
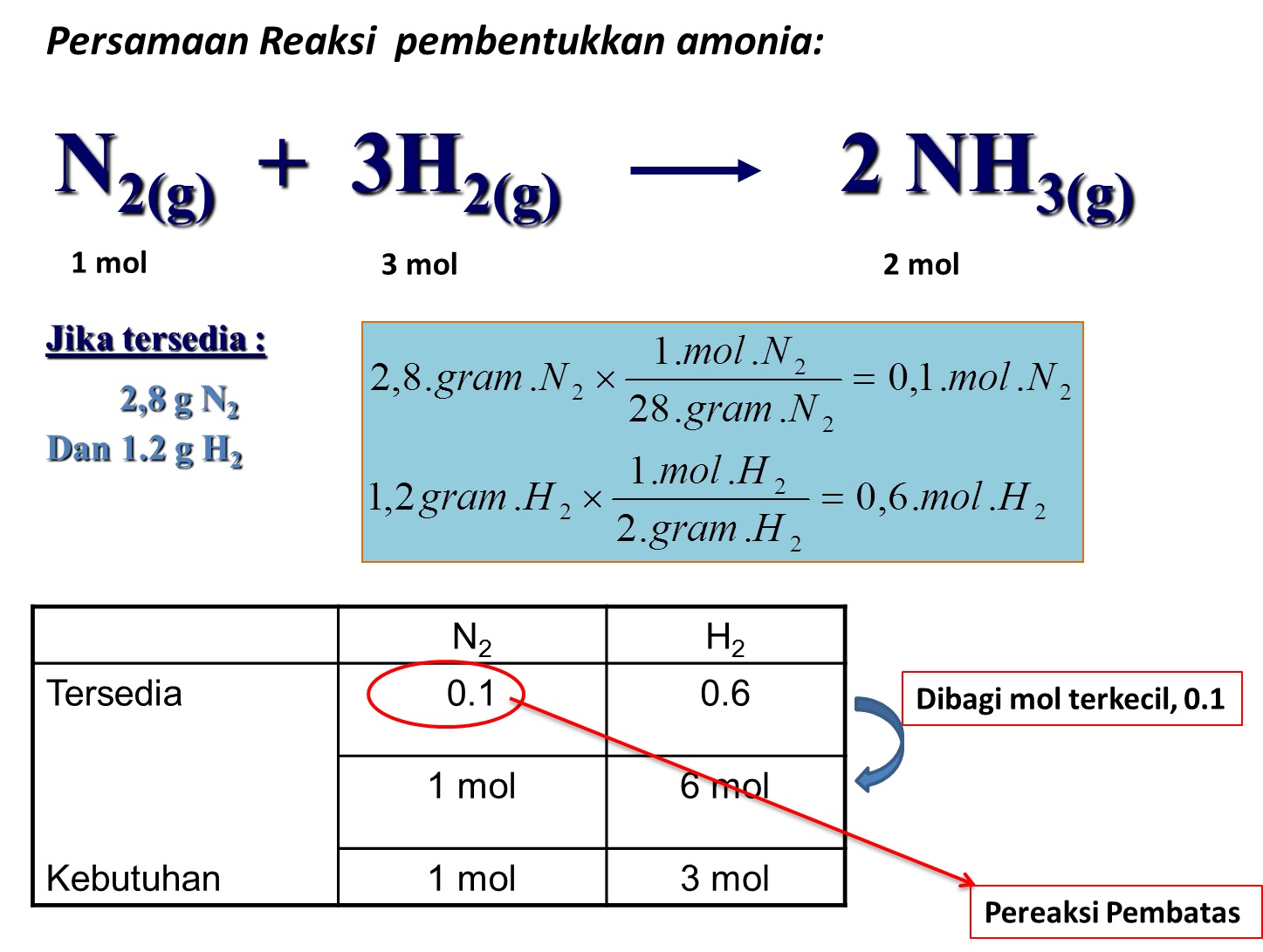
Latihan Soal Titrasi Asam Basa (Sukar) Sebanyak 1,5 gram sampel batuan mengandung kalsium karbonat (CaCO3) dipanaskan hingga hanya terdapat 1 gram padatan. Padatan ini kemudian dilarutkan ke dalam air sehingga terbentuk 20 cm3 larutan yang kemudian dititrasi dengan 1,25 M larutan HCℓ ternyata diperlukan 20 cm3.

PPT TITRASI REDOKS PowerPoint Presentation, free download ID1736483
Untuk membantu memunculkan reaksi yang cepat, maka perlu digunakan katalis. Setelah itu, persamaan stokiometrinya akan jelas dan reaksinya berlangsung sederhana. Ditambah lagi, tidak ada reaksi sampingan yang dapat mempengaruhi reaksi utama. Untuk bisa mempelajari rumus titrasi, mari kenali empat jenis titrasi berikut ini. 1. Titrasi Redoks

Reaksi, Aplikasi, dan Titrasi Asam Basa (Kimia Kelas XI)
Titrasi adalah prosedur menentukan kadar suatu larutan. Dalam titrasi, larutan yang volumenya terukur direaksikan secara bertahap dengan larutan lain yang telah diketahui kadarnya (larutan standar). Berdasarkan jenis reaksi yang terjadi, titrasi dibedakan menjadi titrasi asam basa, titrasi pengendapan, dan titrasi redoks. Sobat Pintar, kali ini kita akan berfokus pada titrasi asam basa, yang.
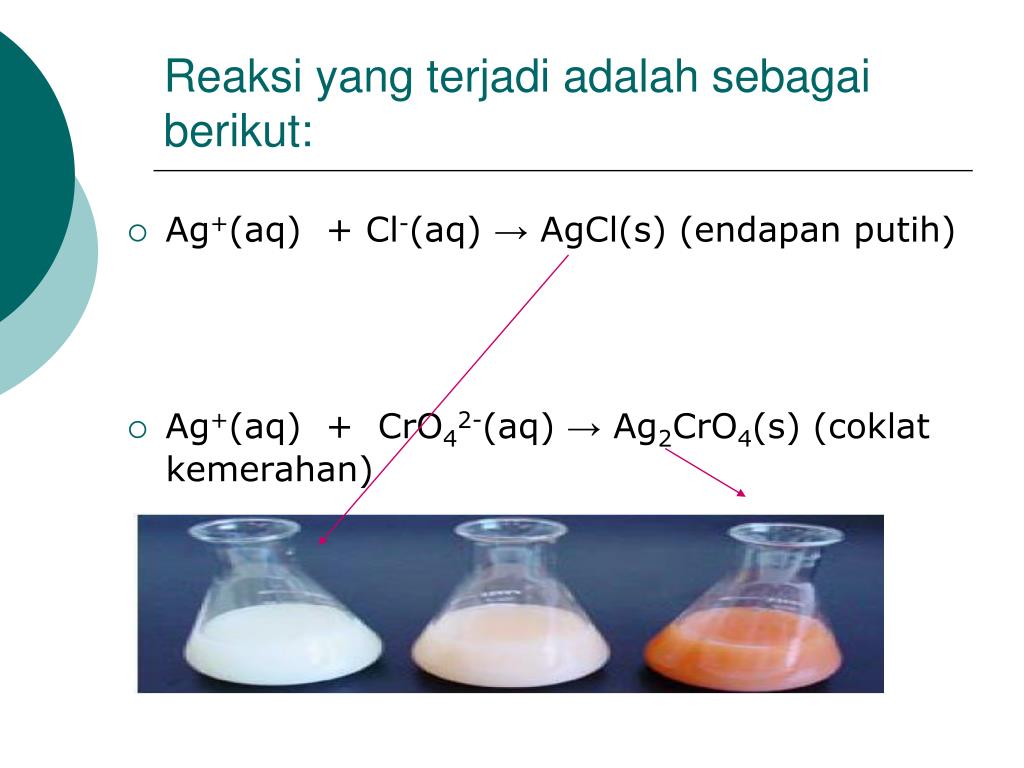
PPT Metode Titrasi Pengendapan Argentometri PowerPoint Presentation, free download ID4447628
Asam dan Basa: Contoh Soal Titrasi. Titrasi adalah teknik kimia analitik yang digunakan untuk menemukan konsentrasi analit yang tidak diketahui (titrand) dengan mereaksikannya dengan volume dan konsentrasi yang diketahui dari larutan standar (disebut titran ). Titrasi biasanya digunakan untuk reaksi asam basa dan reaksi redoks.

Titrasi Asam Basa Pengertian Cara Kerja Jenis Rumus Dan Contoh Soal Dengan Penjelasan Riset
LAPORAN PRAKTIKUM TITRASI ASAM BASA. TITRASI ASAM CUKA EDO ADIANTO RAMADHAN XI. MIA 3 SMA NEGERI 1 SUMBER JL SUNAN MALIK IBRAHIM NO.4 SUMBER CIREBON 45611 2015 f Titrasi Asam-Cuka Landasan Teori Reaksi penetralan dapat digunakan untuk menetapkan kadar atau konsentrasi suatu larutan asam atau basa.
5 Tahapan Reaksi Kimia katelynjou.github.io
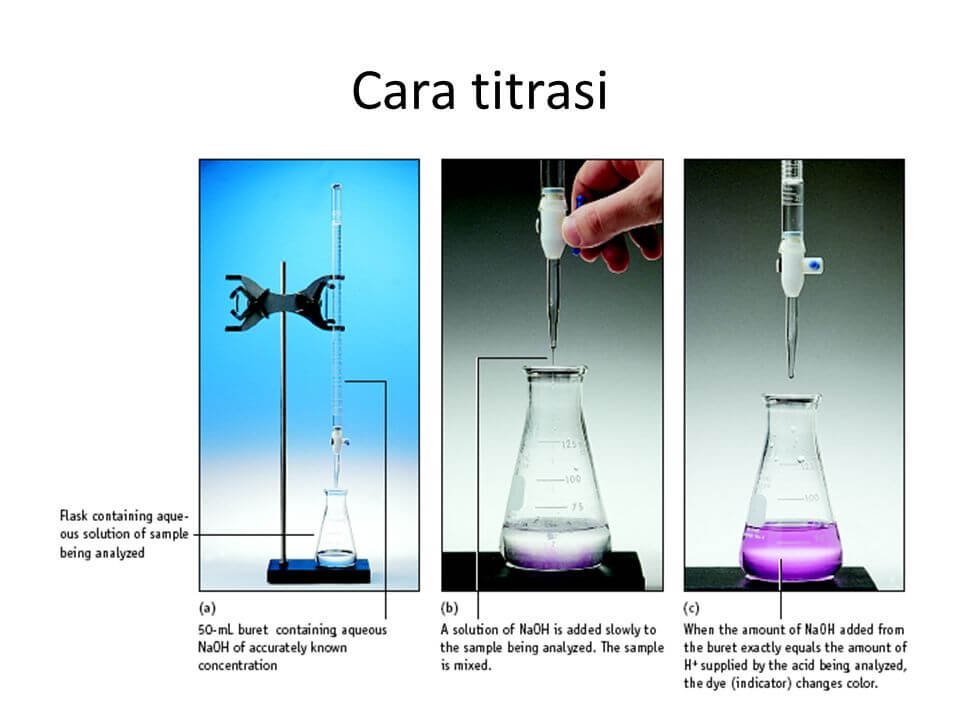
Titrasi asam basa dilakukan dengan menggunakan buret. Buret adalah alat yang digunakan untuk menambahkan standar ke dalam larutan yang akan ditentukan molaritasnya.. Tambahkan zat penitrasi setetes demi setetes dengan selalu menggoyangkan erlenmeyer agar terjadi reaksi sempurna. 4) Sesekali, pinggiran erlenmeyer dibilas agar zat yang.

Percobaan titrasi antara 10 mL larutan H2SO4 dengan NaOH
Pada titik ini, reaksi kimia antara asam dan basa dianggap selesai. Rumus Titrasi Asam Basa yang digunakan dalam titrasi asam basa adalah persamaan keseimbangan reaksi kimia antara asam dan basa. Sebagai contoh, jika reaksi yang terjadi adalah antara asam kuat (HCl) dan basa kuat (NaOH), persamaan reaksinya adalah sebagai berikut:

PPT Persamaan Reaksi PowerPoint Presentation, free download ID6348770
Baca Juga: Kesetimbangan Kimia, Jenis-Jenis, Persamaan Reaksi, dan Tetapannya . Cara Melakukan Titrasi Asam Basa. Oke, sudah tahu pengertian dan alat bahan untuk melakukan titrasi, sekarang saatnya kamu tahu langkah-langkah dalam proses titrasi asam basa agar kamu mengerti cara melakukannya. Eits, tapi ingat! Don't try this at home!

KIMIA ANALISISTITRASI KOMPLEKSOMETRI YouTube
Contohnya reaksi yang terjadi antara HCL dengan NaOH. Prosedur Titrasi Asam Basa. Ketika hendak melakukan titrasi asam basa, ada baiknya mengetahui apa saja prosedur yang dibutuhkan. Untuk melakukan titrasi dibutuhkan sebuah alat berupa buret dan labu Erlenmeyer. Selain itu, titrasi juga memerlukan analit, titran, serta indikator asam basa.

TITRASI REDOKS PERMANGANOMETRI KIMIA ANALITIK YouTube
Nah, hasil dari reaksi ini merupakan reaksi penetralan, yaitu berupa garam dan air dengan pH netral. HCl + NaOH → NaCl + H2O. Titrasi Asidimetri. Selanjutnya, ada titrasi asidimetri yang merupakan kebalikan dari alkalimetri. Titrasi asidimetri adalah titrasi yang menggunakan larutan standar berupa asam.

Analisis Titrasi Pengertian Prinsip Dasar Jenis Rumus Syarat Riset
Bagikan ke: Titrasi asam basa adalah suatu prosedur untuk menentukan kadar (pH) suatu larutan asam/basa berdasarkan reaksi asam basa. Sebelum membahas lebih lanjut mengenai Laporan Praktikum Titrasi Asam Basa, mari perhatikan Daftar Isi berikut.

Persamaan Reaksi Dan Hukum Dasar Kimia
Berdasarkan jenis reaksi yang terjadi, titrasi dibedakan menjadi titrasi asam basa, titrasi pengendapan, dan titrasi redoks. Dalam artikel ini, yang akan dibahas lebih lanjut hanya titrasi asam basa saja.. Persamaan reaksi netralisasi CH 3 COOH dengan NaOH: CH 3 COOH(aq) + NaOH(aq) → CH 3 COONa(aq) + H 2 O(l)

Reaksi, Aplikasi, dan Titrasi Asam Basa (Kimia Kelas XI)
Pengenceran adalah proses penambahan pelarut yg tidak diikuti terjadinya reaksi kimia sehingga berlaku hukum kekekalan mol. Indikator Titrasi. Indikator titrasi adalah indikator yang menandai perubahan pH pada kegiatan titrasi. Indikator akan berubah warna saat larutan mencapai titik ekuivalen.

Penentuan Kadar Vitamin C Back Titration Iodometry Praktikum Biokimia Umum YouTube
Secara prinsip, titrasi dibagi menjadi beberapa jenis namun 4 jenis berikut menjadi yang paling umum dilakukan, yaitu: Titrasi Asam Basa. Titrasi ini merupakan suatu metode penentuan suatu larutan asam dengan larutan basa yang telah diketahui kadarnya, atau sebaliknya. Prinsip titrasi asam basa ini didasarkan pada reaksi netralisasi.
Titrasi Asam Basa
4. Titrasi asam lemah-basa lemah Untuk titrasi menggunakan asam lemah-basa lemah jarang dilakukan, karena larutan akan mengalami perubahan pH yang sangat singkat. Kemudian, belum ada indikator yang dapat mengukur secara cermat perubahan dalam proses titrasi asam lemah dan basa lemah. Selain itu, proses reaksi terjadi secara lambat dan tidak tuntas.

SOALSOAL Menentukan Persamaan Reaksi AsamBasa (Penggaraman) Q&A YouTube
Prinsip dari titrasi permanganometri adalah berdasarkan reaksi oksidasi dan reduksi.Permanganometri adalah titrasi yang didasarkan pada reaksi redoks. Dalam reaksi ini,. permanganat adalah agen unsur pengoksidasi, yang cukup kuat untuk mengoksidasiMn(II) menjadi MnO 2 sesuai dengan persamaan : 3Mn 2+ + 2MnO 4-+ 2H 2 O → 5MnO 2 + 4H +