
Perhatikan reaksi inti berikut ini. a b X + gamma > p q
Perhatikan persamaan reaksi berikut. N 2 (g) + 3H 2 (g) → 2NH 3 (s) Jika 1 mol N 2 direaksikan dengan 2 mol H 2, tentukan: Pereaksi pembatas; Jumlah mol yang tersisa; Jumlah mol NH 3; Pelajari Juga: 15 Soal tentang Tata Surya Kelas 7 Semester 2 dan Kunci Jawaban. Pembahasan: 1. Pereaksi Pembatas.

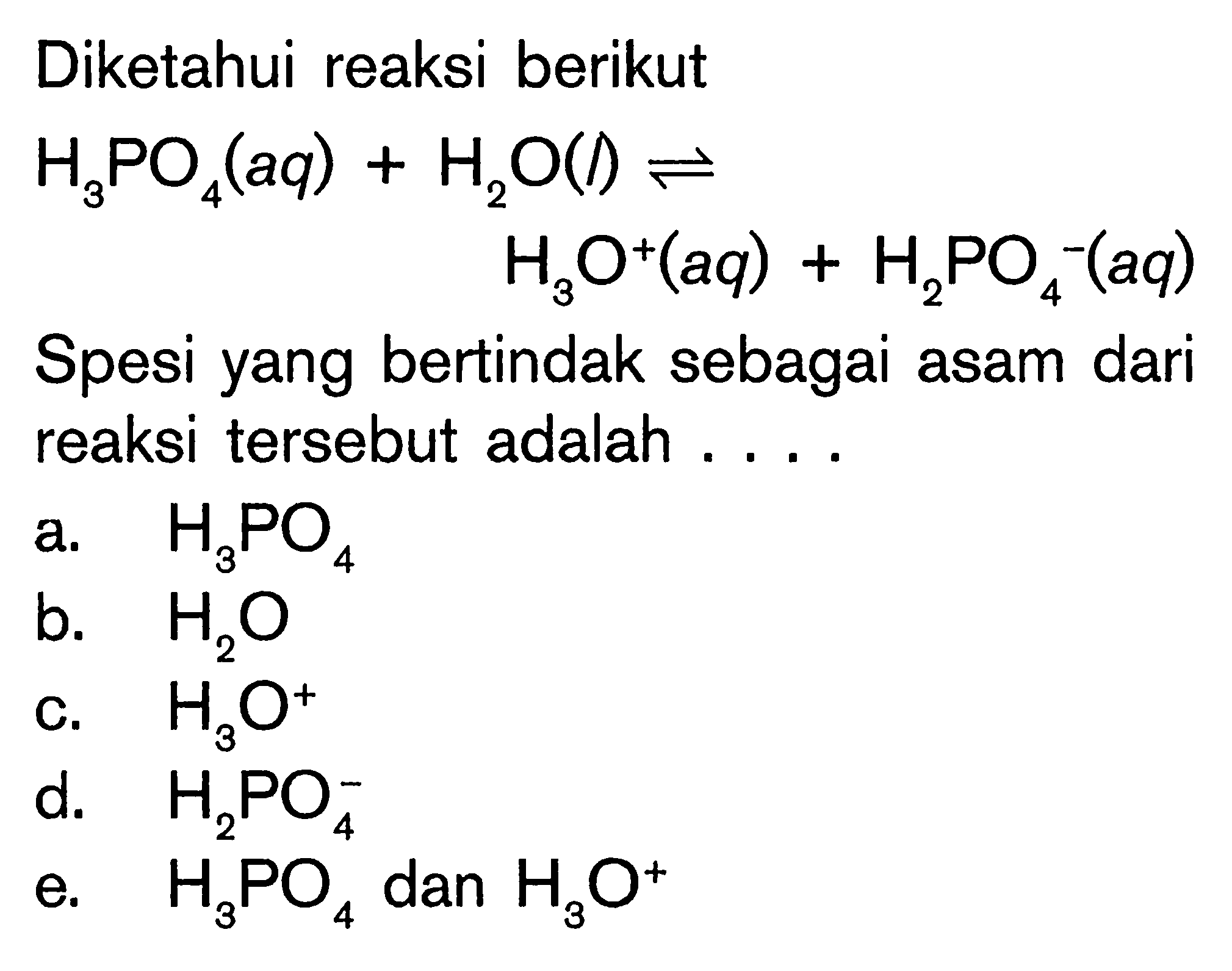
Perhatikan reaksi berikut.NH3 + H2O NH4+ + OHMenurut konsep BronstedLowry, yang bertindak
Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl ——> MgCl 2 (aq) + H 2 (g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.

Perhatikan reaksi pembakaran berikut.CH4 (g) + 2O2 (g) CO2 (g) + 2H2O (g). Pada pembakaran YouTube
Perhatikan reaksi fusi berikut!. 1 H 1 + 1 H 1 → 1 H 2 + 1 e o + E Jika massa atom 1 H 1 = 1,009 sma, 1 H 2 = 2,014 sma, 1 e o = 0,006 sma dan 1 sma setara 931 MeV, maka energi yang dihasilkan dari reaksi ini adalah A. 1,862 MeV B. 1,892 MeV C. 1,982 MeV D. 2,289 MeV E. 2,298 MeV. Pembahasan / penyelesaian soal.

Perhatikan reaksi senyawa hidrokarbon berikut. CH2 = CH
Jadi, laju reaksi saat konsentrasi P 2 Q yang terbentuk adalah 0,8 mol adalah 0,008 M/detik. Jawaban: B. Contoh Soal 8. Perhatikan reaksi berikut. AB + C 2 → ABC 2. Reaksi di atas memiliki persamaan laju reaksi r = k[AB] 2 [C 2]. Tentukan orde reaksi totalnya! Pembahasan: Sebelum menentukan orde reaksi total, kamu harus tahu dulu orde masing.

perhatikan reaksi berikut. NH3(aq)+H2O(l) NH4^+ (aq)...
Iklan. Pertanyaan. Perhatikan reaksi berikut. 2N2O5(g) ⇌ 4NO2(g)+O2(g) H = −T kkal. Reaksi kesetimbangan bergeser ke kiri jika. Konsentrasi ditambah. Suhu diturunkan. Tekanan diperkecil. Konsentrasi dikurangi.

Perhatikan skema rangkaian reaksi berikut! Universityku
Ketika besi dibakar dalam keadaan terbuka menghasilkan senyawa Fe 2 O 3 dengan persamaan reaksi sebagai berikut: 4Fe (s) + 3O 2 (g) ---> 2Fe 2 O 3 (s) Berdasarkan pernyataan diatas manakah yang merupakan REDUKTOR..? Fe. O 2. Fe 2 O 3. Fe dan O2 . Tidak mengalami reduksi.. Perhatikan reaksi berikut: 2 C l.

Perhatikan Diagram Entalpi Reaksi Berikut Besarnya Perubahan Entalpi Delta H1 Adalah
Perhatikan persamaan reaksi berikut! H 2 O + SO 3 → H 2 SO 4 Berdasarkan teori Lewis, sifat H 2 O yang tepat dalam reaksi tersebut beserta penjelasannya yaitu.. 48. 5.0. Jawaban terverifikasi. Di antara senyawa di bawah ini, basa Lewis yang terkuat adalah.. 21. 3.6. Jawaban terverifikasi.

Perhatikan reaksi redoks berikut! a MnO4^ + b H^+ + c H2...
Contoh soal 6. Perhatikan reaksi berikut. Tentukan besarnya energi ikatan antara atom C dan H! Pembahasan: Di soal kamu diminta untuk menentukan energi ikatan antara atom C dan H. Energi ikatan merupakan energi yang dibutuhkan untuk memutus ikatan antara dua atom.

Perhatikan Diagram Entalpi Reaksi Berikut Besarnya Perubahan Entalpi Delta H1 Adalah
Reaksi pembentukan amonia setelah setara adalah sebagai berikut: N 2(g) + 3H 2(g) ⇌ 2NH 3(g) Sehingga perbandingan volume gas N 2, H 2 dan NH 3 berturut - turut adalah 1 : 3 : 2. 9. Senyawa oksida logam M x O y dihasilkan dari reaksi antara padatan logam M sebanyak 0,5 mol dengan 0,625 mol gas oksigen. Jika reaksi tersebut menghasilkan 0,25.

Perhatikan data percobaan reaksi berikut! Mg (s)+2HCl (aq...
Berdasarkan pelepasan dan pengikatan oksigen, reaksi reduksi adalah reaksi pelepasan oksigen, sedangkan reaksi oksidasi adalah reaksi pengikatan oksigen. mengalami reaksi oksidasi karena terjadi pengikatan oksigen. 2. , mengalami reaksi reduksikarena terjadi pelepasanoksigen. 3. mengalami reaksi oksidasi karena terjadi pengikatan oksigen. 4 .
Perhatikan reaksi berikut.CaO(s)+CO2(g)>CaCO3(s)Reaksi t...
Dalam reaksi ini, fruktosa akan mereduksi ion Cu 2+ dalam Fehling menjadi ion Cu + sehingga dihasilkan endapan merah bata. Baca Juga: Latihan Soal Ujian Nasional 2019 Fisika SMA dan Pembahasannya. 15. Topik : Reduktor Oksidator. Perhatikan reaksi redoks berikut! 2Cr + 3CuSO 4 → Cr 2 (SO 4) 3 + 3Cu. Pada reaksi tersebut yang merupakan reduktor.

Perhatikan reaksi ionisasi air berikut!H2O(l) H^+(aq)...
Perhatikan reaksi berikut! Reaksi tersebut menunjukkan contoh jenis reaksi.. 20. 0.0. Jawaban terverifikasi. Iklan. Iklan. Diketahui reaksi-reaksi senyawa karbon : CH 3 CH 2 CH 2 CH 2 OH + HBr → CH 3 CH 2 CH 2 CH 2 Br + H 2 O jenis dari reaksi senyawa karbon di atas adalah. 17. 0.0. Jawaban terverifikasi. Lengkapilah tabel berikut..

Perhatikan Diagram Entalpi Reaksi Berikut Besarnya Perubahan Entalpi Delta H1 Adalah
Dari reaksi tersebut digolongkan ke dalam reaksi adisi, karena terjadi reaksi pemutusan ikatan rangkap (rangkap dua menjadi tunggal) 2. Perhatikan reaksi berikut! CH 3 CH 2 CH = CH 2 + Br 2 → CH 3 CH 2 CHBrCH 2 Br. Jenis reaksi yang terjadi pada persamaan reaksi tersebut adalah.. A. substitusi. B. oksidasi. C. eliminasi. D. adisi. E.

Perhatikan reaksi berikut. NH3+H2O NH4^(+)+OH^() Menur...
Contoh Soal Persamaan Reaksi Kimia dan Pembahasan. Tuliskan persamaan reaksi setara untuk setiap reaksi berikut. a. larutan kalium hidroksida dengan larutan asam fosfat membentuk larutan kalium fosfat dan air. b. aluminium dengan larutan asam nitrat membentuk larutan aluminium nitrat, air, dan gas nitrogen dioksida.

Perhatikan Diagram Entalpi Reaksi Berikut Besarnya Perubahan Entalpi Delta H1 Adalah
Perhatikan tabel berikut. x (mol). Contoh Soal 7. Reaksi pembakaran 32 gram gas metana berlangsung seperti reaksi berikut. CH 4 + 2O 2 → CO 2 + 2H 2 O. Jika massa oksigen yang digunakan pada pembakaran tersebut 160 gr, banyaknya mol H 2 O yang terbentuk adalah.. (Ar C = 12, O = 16) 4 mol; 3 mol; 2 mol;

Perhatikan reaksi berikut. CHCl3(g)+Cl2(g) > CCl4(g)+HCl...
Perhatikan persamaan reaksi di bawah ini!. Asam orto periodik merupakan oksidator menurut reaksi berikut. Reaksi tersebut terjadi pada suasana asam. Jika 3 mol asam orto periodik tepat habis bereaksi, jumlah yang terbentuk sebanyak.. 8 mol; 9 mol; 10 mol; 11 mol; 12 mol; Jawaban: B.