
Kimia 12 Molaritas Molalitas dan Fraksi Mol YouTube
Zat yang dilarutkan ini menentukan sifat-sifat larutan tersebut yang dinamakan sebagai sifat koligatif larutan. Untuk mempelajari tentang sifat koligatif larutan, terlebih dulu kita harus mengetahui bagaimana cara menghitung konsentrasi larutan. Konsentrasi larutan adalah jumlah zat terlarut didalam larutan dalam satuan molaritas dan molaritas.

Apa Pengertian Dan Perbedaan Molaritas Dan Molalitas?
Pengertian Molaritas. Sebelum masuk ke rumus molaritas dan contoh soal, elo harus mengetahui dasarnya dulu tentang apa itu molaritas. Molaritas adalah salah satu ukuran kelarutan yang menyatakan jumlah mol suatu zat per volume larutan. Molaritas ini dilambangkan dengan huruf "M" dengan satuannya molar atau M yang setara dengan mol/liter.

Rumus Molaritas Normalitas Dan Molalitas PDF
Menjelajahi perbedaan molalitas dan molaritas dalam kajian kimia. Molalitas dan molaritas adalah dua konsep penting dalam konsentrasi larutan. Molalitas merujuk pada jumlah mol zat pelarut per kilogram pelarut, sedangkan molaritas merujuk pada jumlah mol zat terlarut per liter larutan. Dengan pemahaman yang mendalam tentang perbedaan ini, kita dapat mengembangkan pemahaman yang lebih baik.

NORMALITAS LARUTAN HUBUNGAN NORMALITAS & MOLARITAS Seri Konsentrasi Larutan MK Kimia Dasar
Rumus normalitas kimia adalah N = n x a /V, yang menyatakan nilai normal (N) yang sama dengan satu mol ekivalen/liter. Dalam kimia, terdapat beberapa besaran yang dapat digunakan untuk menyatakan suatu konsentrasi zat terlarut dalam sebuah larutan antara lain yaitu molaritas, molalitas, normalitas dan fraksi mol.

apa perbedaan molalitas dan molaritas Brainly.co.id
Rumus normalitas digunakan untuk menghitung konsentrasi larutan dalam ilmu kimia. Contohnya, dengan menggambarkan jumlah mol ekivalen dalam per liter larutan. Sedangkan, molaritas merupakan satuan yang menyatakan jumlah zat terlarut per liter larutan dan molalitas dalam 1.000 gram pelarut. Mengutip Jurnal Biomedika Volume 10 Nomor 1 berjudul.
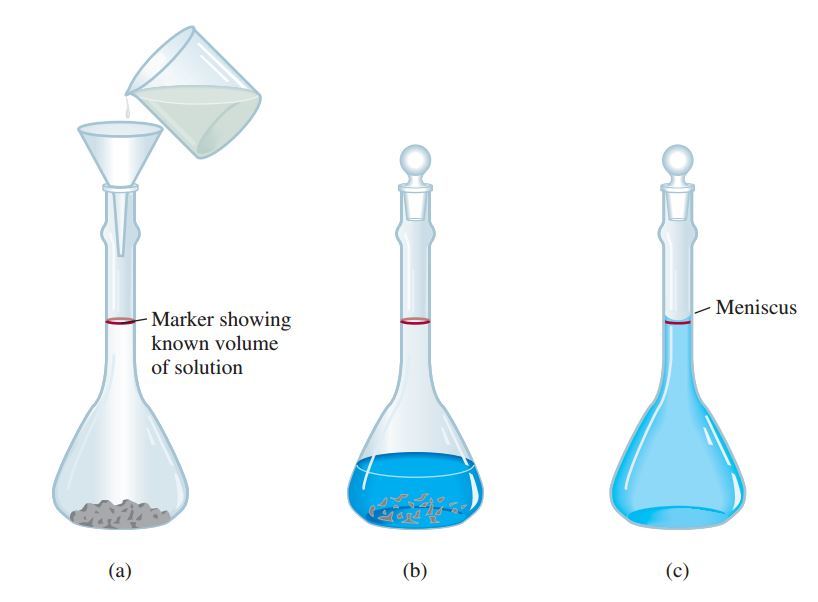
√ Rumus Normalitas, Molaritas, Molalitas Pengertian, Rumus, Contoh Soal dan Pembahasan
Rumus Normalitas, Molaritas, dan Molalitas. Berdasarkan pengertian tersebut, Grameds dapat menyimpulkan bahwa definisi ini hampir sama dengan pengertian molaritas. Perbedaan keduanya terdapat pada penyebutnya di mana molalitas memakai massa zat pelarut dalam 1kg, sedangkan molaritas menggunakan volume larutan dalam 1liter..

Cara Menghitung Normalitas Kimia Rumus Molaritas dan Normalitas Praktikum Kimia Analisis
Dalam bidang kimia ada beberapa satuan yang sering digunakan untuk menyatakan konsentrasi larutan ( banyaknya zat terlarut dalam sejumlah pelarut ). Beberapa satuan konsentrasi itu antara lain : mol, molalitas, molaritas, normalitas, ppm, persen massa, persen volum. Berikut akan saya jelaskan pengertian dan rumus dari satuan-satuan di atas : 1.

Perbedaan Molaritas Dan Molalitas Riset
Cara Menghitung Normalitas Kimia - Rumus Molaritas dan Normalitas - Praktikum Kimia Analisis DasarBagi kamu yang masih bingung dalam melakukan perhitungan N.

Pengertian Normalitas, Rumus, Dan Contoh Soal Soal Serta Jawabannya Ilmu Kimia
Setelah memahami perbedaan molaritas dan normalitas, kita bisa menyimpulkan bahwa kedua istilah ini memiliki peran yang penting dalam dunia kimia. Molaritas digunakan dalam berbagai eksperimen kimia dan pengukuran konsentrasi larutan secara umum. Sementara itu, normalitas digunakan dalam reaksi asam-basa dan reaksi redoks, di mana perhitungan.

Molaritas, Normalitas dan Pengenceran.pdf
Perbedaan utama antara normalitas dan molaritas adalah bahwa yang pertama menyatakan jumlah zat terlarut dalam hal jumlah ekuivalen, bukan mol. Masalah besar dengan normalitas bagi kebanyakan orang adalah, tidak seperti molaritas, solusi yang sama dapat memiliki lebih dari satu normalitas, karena konsep jumlah ekuivalen bergantung pada untuk apa zat terlarut digunakan atau dengan cara apa. itu.

Konsentrasi Larutan Molaritas, Molalitas, Fraksi Mol, Berat, Normalitas
Apa Perbedaan Antara Molaritas dan Normalitas - Perbandingan Perbedaan Kunci. Istilah Kunci: Konsentrasi, Molaritas, Konsentrasi Molar, Normalitas, Spesies Reaktif. Apa itu Molaritas? Molaritas adalah jumlah mol senyawa yang hadir dalam liter larutan. Itu.

(DOC) Molaritas Molalitas Normalitas Rizal Faiz Academia.edu
Molaritas dan normalitas mengukur konsentrasi menggunakan dua pendekatan yang berbeda. Molaritas, juga dikenal sebagai konsentrasi molar, mengukur jumlah mol suatu zat yang ada dalam per liter larutan. Molaritas dilambangkan dengan huruf kapital M. Jadi solusi dengan 1.0M akan menyatakan bahwa ia mengandung 1 mol solut per liter larutan.

Konsep Mol Molaritas (Stoikiometri Kimia SBMPTN, SMA) YouTube
Perbedaan Molalitas dan Molaritas. Molaritas (M) ailah banyaknya mol zat terlarut dalam 1 liter larutan, sedangkan Molalitas (m) ialah banyaknya mol zat terlarut dalam 1kg pelarut. Moralitas ( M ) yaitu satuan konsentrasi yang banyak dipakai dan didefinisikan sebagai banyak mol zat terlarut dalam 1 liter larutan dalam satuan M. Sedangkan

Apa Perbedaan Antara Molaritas Molalitas Dan Normalitas My XXX Hot Girl
Menjelajahi perbedaan antara normalitas dan molaritas dalam konteks kimiawi menjadi landasan penting dalam pemahaman kita tentang larutan. Normalitas dan molaritas adalah dua istilah yang sering digunakan untuk mengukur konsentrasi zat dalam larutan, tetapi memiliki perbedaan signifikan yang perlu dipahami. Normalitas mengacu pada jumlah reaktan yang berpartisipasi dalam suatu reaksi kimia.

Perbedaan Rumus Molaritas dan Molalitas
Molaritas, Molalitas dan Normalitas Larutan - Pengertian, Rumus dan Contoh Soal TERLENGKAP. Molaritas, molalitas dan normalitas merupakan salah satu satuan dalam konsentrasi larutan yang berguna untuk menyatakan hubungan kuantitatif antara zat terlarut dan zat pelarut. Untuk lebih jelasnya dibawah ini akna dijelaskan tentang pengertian.

Perbedaan Rumus Molaritas Dan Molalitas 52 Riset
Pembahasan. Menurut persamaan, 2 mol ion H + (2 ekuivalen) dari asam sulfat (H 2 SO 4) bereaksi dengan natrium hidroksida (NaOH) membentuk natrium sulfat (Na 2 SO 4) dan air. Jika pada soal diketahui molaritas suatu zat, maka gunakan rumus berikut untuk mencari normalitasnya: N = molaritas x ekuivalen. N = 0,1 x 2.