
Pengertian Titik Beku Pada Suhu Zat Cair LABORATORIUM SMK
Tekanan yang Mempengaruhi Penurunan Titik Beku. Tekanan adalah salah satu faktor yang mempengaruhi titik beku suatu zat. Sebagai contoh, jika tekanan udara di suatu tempat menurun, maka titik beku air juga akan menurun. Hal ini dikarenakan ketika tekanan berkurang, molekul-molekul air memiliki energi kinetik yang lebih tinggi sehingga lebih.

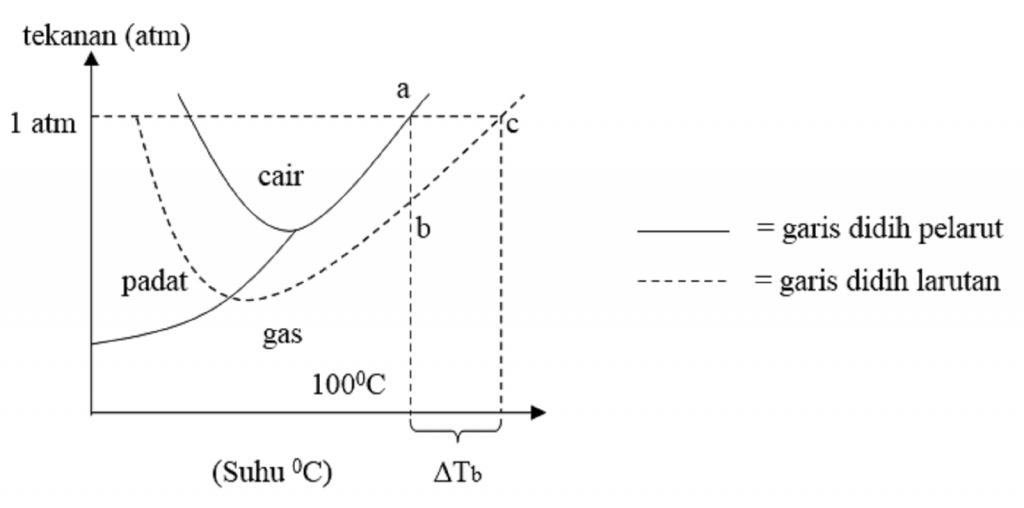
Perhatikan diagram PT air, larutan urea 0,1 m dan NaC...
Contoh aplikasi penurunan titik beku adalah dengan menaburkan garam di jalanan musim dingin. Pada musim dingin, uap air dan air mudah membeku membentuk lapisan es, sehingga jalanan sulit untuk dilewati. Penaburan garam dilakukan untuk menurunkan titik beku es di jalanan. Sehingga, es terbentuk pada suhu yang lebih rendah daripada suhu musim dingin.

Penurunan Titik Beku Contoh Soal [Pembahasan Simpel] YouTube
Penurunan titik beku adalah fenomena fisika di mana titik beku suatu zat cair, seperti air, menurun ketika zat tersebut dicampur dengan zat lain (biasanya dalam bentuk larutan atau campuran). Fenomena ini terjadi karena adanya interaksi antara zat-zat dalam larutan yang mengganggu tata letak molekul atau partikel dalam fase padat, sehingga.

Menentukan Rumus Molekul Senyawa dari Penurunan Titik Beku YouTube
Penurunan titik beku adalah fenomena fisika di mana titik beku suatu zat cair, seperti air, menurun ketika zat tersebut dicampur dengan zat lain (biasanya dalam bentuk larutan atau campuran). Fenomena ini terjadi karena adanya interaksi antara zat-zat dalam larutan yang mengganggu tata letak molekul atau partikel dalam fase padat, sehingga.

Gambar di bawah ini adalah kurva penurunan titik beku dar...
Penurunan titik beku adalah selisih antara titik beku pelarut dan titik beku larutan dimana titik beku larutan lebih rendah dari titik beku pelarut.Titik beku pelarut murni seperti yang kita tahu adalah 0ºC. dengan adanya zat terlarut misalnya saja gula yang ditambahkan ke dalam air maka titik beku larutan ini tidak akan sama dengan 0ºC.

Penurunan Titik Beku Larutan Dan Contoh Soal Faktasantuy Com My XXX Hot Girl
Penurunan titik beku adalah fenomena di mana suatu zat cair mengalami penurunan suhu titik beku saat ditambahkan suatu substansi, biasanya dalam bentuk zat terlarut atau koloid. Proses ini dapat dijelaskan dengan hukum Raoult dan hukum Henry, yang masing-masing berkaitan dengan penurunan titik beku pada larutan ideal dan larutan non-ideal.

Manfaat Penurunan Titik Beku Ilmu Kimia
Jawabannya adalah air gula. Buat yang belum percaya silahkan dipraktekan dirumah. Semakin banyak jumlah gula yang terlarut maka akan lebih lama mendidihnya. Pada peristiwa tersebut terjadi kenaikan titik didih larutan.. Penurunan titik beku (ΔT f) = T f o - T f = m K f = 2,5 x 1,86 = 4,65 Titik beku = 0 - 4,65 = -4,65 o C. Share this:
Kenaikan Titik Didih Penurunan Titik Beku Sifat Koligatif Larutan Reverasite
Penurunan titik beku adalah selisih antara titik beku pelarut dengan titik beku larutan. Penurunan titik beku ini termasuk salah satu sifat koligatif larutan. Dalam perhitungan kimia, penurunan titik beku disimbolkan dengan ΔT f (f berasal dari kata freeze) atau ΔT b . Peristiwa penurunan titik beku ini sering diterapkan pada negara-negara.

Penurunan Titik beku YouTube
Penurunan titik beku adalah penurunan titik beku pelarut akibat penambahan zat terlarut yang tidak mudah menguap. Contohnya termasuk penambahan garam dalam air, alkohol dalam air, atau pencampuran dua padatan seperti pengotor menjadi obat bubuk halus. Dalam kasus terakhir, senyawa yang ditambahkan adalah zat terlarut, dan padatan asli dianggap.

Data percobaan penurunan titik beku Larutan Konsentrasi
LAPORAN PRAKTIKUM KIMIA PENURUNAN TITIK BEKU LARUTAN. Titik beku adalah suhu dimana tekanan uap cairan sama dengan tekanan uap padatannya. Titik beku larutan lebih rendah daripada titik beku pelarut murni. Hal ini disebabkan zat pelarutnya harus membeku terlebih dahulu, baru zat terlarutnya. Jadi larutan akan membeku lebih lama daripada pelarut.

Penerapan Sifat Koligatif Penurunan Titik Beku
Misalnya, titik beku normal air adalah 0 o C. Akan tetapi, dengan adanya zat terlarut pada suhu 0 o C, air bisa mejadi belum membeku. Selisih titik beku pelarut (Tf o) dengan titik beku larutan (Tf) yang kemudian disebut penurunan titik beku (ΔTf). Berikut rumus penurunan titik beku: ΔTf = Tf° - Tf

Rumus titik beku larutan
Berikut rumus penurunan titik beku. Titik beku bisa diartikan sebagai suhu saat zat cair berubah menjadi padat. Berikut rumus penurunan titik beku.. 1,86 ° C Tfl = - 1,86 ° C Jadi, titik beku larutan adalah - 1,86 ° C. Soal 2. Tentukan titik beku larutan 0,025 mol suatu senyawa dalam 250 gram air, jika Kf air = 1,86º C/m! Jawaban: m.

Apa yang dimaksud dengan penurunan titik beku 2021
Rumus penurunan titik beku Penurunan titik beku berbanding lurus dengan.. NaOH jika dilarutkan kedalam air akan terbentuk larutan elektrolit sehingga rumus penurunan titik beku yang digunakan adalah rumus untuk larutan elektrolit. Pada soal ini diketahui: Kf = 1,86; 4% berarti massa NaOH = 4 gram dan massa air = 100 gram.

PENURUNAN TITIK BEKU Ilmu Kimia
Penurunan titik beku adalah penurunan titik beku pelarut akibat penambahan zat terlarut yang tidak mudah menguap. Contohnya termasuk penambahan garam dalam air, alkohol dalam air, atau pencampuran dua padatan seperti pengotor menjadi obat bubuk halus. Dalam kasus terakhir, senyawa yang ditambahkan adalah zat terlarut, dan padatan asli dianggap.

Diketahui data percobaan penurunan titik beku bebe...
Kemudian, adanya penurunan tekanan uap jenuh larutan akan mengakibatkan penurunan titik beku larutan. Dapat dikatakan bahwa, larutan akan membeku pada temperatur yang lebih rendah. Baca Juga: Pengertian Senyawa Polimer. Nah, berdasarkan penjalasan tadi, dapat dinyatakan bahwa penurunan titik beku larutan adalah selisih antara titik beku pelarut.

Laporan Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Persamaan Penurunan Titik beku. Penurunan titik beku dapat dihitung menggunakan persamaan Clausius-Clapeyron dan hukum Raoult. Dalam larutan ideal encer titik beku adalah: Titik beku larutan total = Titik beku larutan - ΔTf. dimana ΔTf = molalitas * Kf * i. K f = konstanta titik beku air (1,86 ° C kg / mol ) i = Faktor Van't Hoff.