
Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Penjelasan Lengkap: jelaskan pengertian asam basa menurut arrhenius bronsted lowry dan lewis 1. Svante Arrhenius mengembangkan teori Asam Basa Arrhenius pada tahun 1887 yang menyatakan bahwa asam adalah senyawa yang menghasilkan ion hidrogen (H+) saat larut dalam air, sedangkan basa adalah senyawa yang menghasilkan ion hidroksida (OH-) saat larut dalam air.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Teori asam basa Arrhenius dikemukakan oleh Swedia Svante Arrhenius pada tahun 1884 menjadikannya teori pertama yang mengklasifikasikan senyawa menjadi asam dan basa. Dilansir dari Chemguide, menurut Arrhenius, asam adalah zat yang menghasilkan ion hidrogen (H+) dalam larutan sedangkan basa adalah zat yang menghasilkan ion hidroksida (OH-) dalam.

Teori Asam Basa Arrhenius Keunggulan dan Kelemahan Konsep Asam Basa Arrhenius YouTube
Teori Asam Basa Menurut Arrhenius Dilansir Arni Wiyati dalam Kimia (2020:9), Arrhenius menjabarkan asam sebagai zat yang ketika dimasukkan dalam air menghasilkan ion hydronium (H+). Lebih jelasnya, asam diidentikan dengan zat yang berupa kovalen polar dan akan larut di air.. Pengertian Asam, Basa, dan Garam: Ciri, Contoh, dan Rangkuman.

Teori Asam Dan Basa Arrhenius PDF
Berikut ini beberapa pengertian asam basa menurut para ahli, yaitu : Teori Asam Basa Arrhenius. Menurut teori Arrhenius, asam dan basa didefinisikan dalam konteks larutan air. Berikut adalah dua konsep utama dalam Teori Asam Basa Arrhenius: Asam Menurut Arrhenius. Menurut Arrhenius asam adalah zat yang dapat menghasilkan ion hidrogen (H.

Pengertian Asam dan Basa Serta Penggunaannya
Dalam artikel ini, kita akan membahas pengertian asam dan basa menurut Arrhenius beserta contoh-contoh dari kedua konsep tersebut. Pengertian Asam Menurut Arrhenius. Menurut konsep Arrhenius, asam adalah suatu senyawa kimia yang dapat menghasilkan ion hidrogen (H+) ketika larut dalam air. Dengan kata lain, asam adalah zat yang dapat melepaskan.

Teori Asam Basa
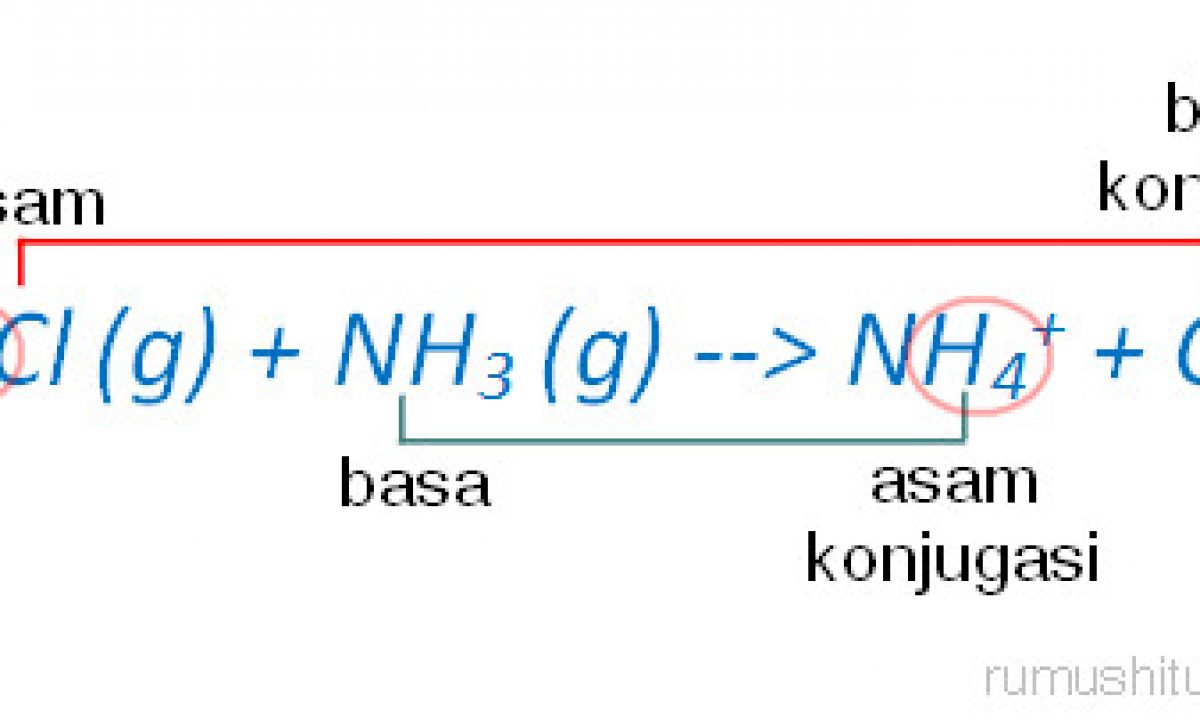
2. Teori Asam Basa Bronsted dan Lowry Teori asam basa yang kedua merupakan teori asam basa yang muncul untuk dapat menyempurnakan kekurangan yang ada pada teori Arrhenius. Yaitu dengan keterbatasan pelarut, yaitu hanya senyawa air saja serta dapat menjelaskan reaksi dari asam basa yang terjadi pada fase cair, gas, serta fase padat pula.
Get Contoh Soal Asam Basa Menurut Arrhenius Gif Riset
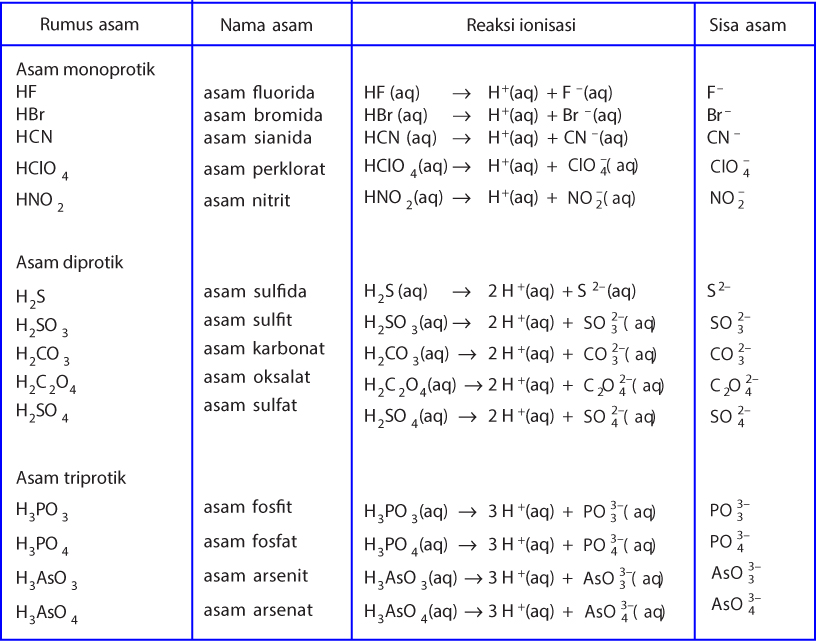
- Ion sisa asam adalah: ion negatif yang terbentuk dari asam setelah melepas ion H+ Pengertian basa Menurut Arrhenius, basa adalah semua zat yang jika dilarutkan dalam air akan menghasilkan ion OH- misalnya pada senyawa natrium hidroksida NaOH akan terurai menjadi Na+ dan OH-. Jika basa bereaksi dengan asam, maka dihasilkan senyawa 'garam'.

Teori Asam Basa
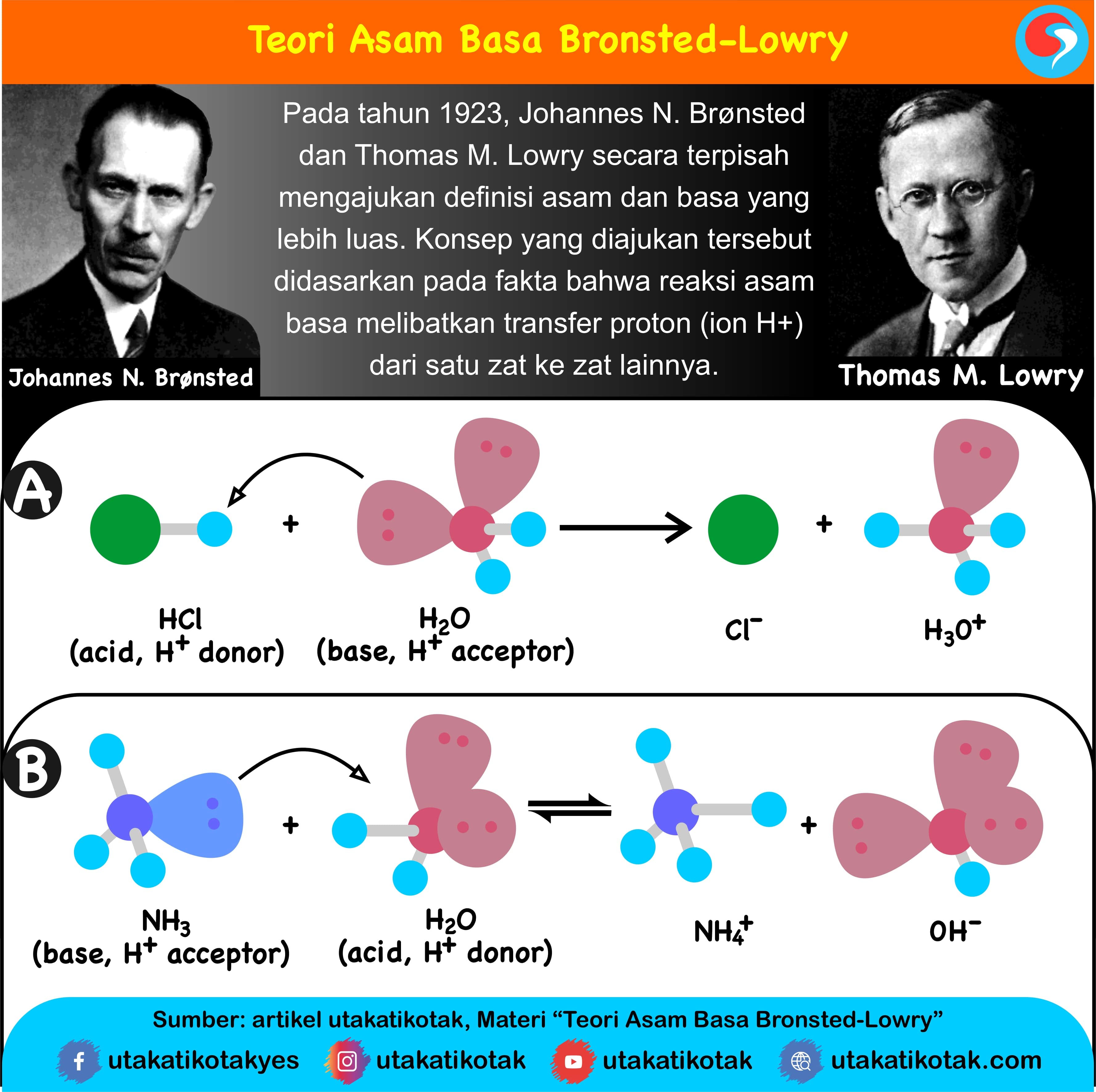
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.

Asam Basa Arrhenius Bagian 1 (Definisi Asam Basa) Materi Larutan Asam Basa Kimia SMA Pojan
Teori Asam Basa Arrhenius. Teori ini pertama kalinya dikemukakan pada tahun 1884 oleh Svante August Arrhenius. Menurut Arrhenius, definisi dari asam dan basa, yaitu: asam adalah senyawa yang jika dilarutkan dalam air melepaskan ion H +. basa adalah senyawa yang jika dilarutkan dalam air melepaskan ion OH −.

PPT TEORI ASAM DAN BASA PowerPoint Presentation, free download ID3560268
Berdasarkan pendekatan Arrhenius, ada beberapa karakteristik yang dapat digunakan untuk mengidentifikasi asam: 1. Asam menghasilkan ion hidrogen (H+) ketika dilarutkan dalam air. 2. Asam dan basa adalah dua konsep penting dalam kimia. Salah satu definisi yang paling umum digunakan untuk asam dan basa adalah yang dikemukakan oleh Svante.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis
Mereka adalah Svante Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan mengenai teori-teori yang mereka kemukakan: 1. Asam Basa Menurut Arrhenius. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hydronium (H+) saat dimasukkan ke dalam air. Sedangkan basa, menghasilkan zat lain yang berupa ion hidroksida (OH-).

Teori Asam dan Basa Menurut Arrhenius
Baca juga: Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah. Contoh asam arrhenius adalah asam klorida (HCl), asam sulfat (H2SO4), asam nitrat (HNO3), dan semua senyawa yang menghasilkan ion hidrogen dalam air. Adapun, menurut Arrhenius basa adalah senyawa yang meningkatkan konsentrasi OH- dalam larutan berair. Artinya, basa adalah zat yang jika.

Teori Asam Basa Arrhenius Youtube Riset
Jelaskan pengertian asam dan basa menurut Arrhenius! Mengutip buku Kimia: Asam, Basa, dan Larutan Penyangga oleh Dodi Satriawan, dkk (2023) asam basa merupakan larutan elektrolit yang memiliki ciri-ciri khusus. Asam dan basa merupakan teori yang pertama kali dicetuskan oleh Svante Arrhenius, seorang ahli kimia asal Swedia. Teori ini mengaitkan sifat keasaman dengan ion hidrogen (H+).

Pengertian Asam Basa Menurut Arrhenius, BronstedLowry, dan Lewis
Asam dan basa pengertian menurut Kamus Besar Bahasa Indonesia (KBBI), asam adalah zat yang dapat memberikan proton, zat yang dapat membentuk ikatan kovalen dengan menerima sepasang elektron.. Teori Arrhenius. Asam basa Arrhenius menyatakan bahwa asam adalah zat yang apabila dilarutkan dalam air akan menghasilkan ion H + dalam larutan dan.
Berilah contoh yang dapat menjelaskan teori asam basa menurut arrhenius
30 Agustus 2023. jelaskan pengertian asam dan basa menurut arrhenius -. Asam dan basa adalah salah satu konsep kimia yang paling dasar. Menurut teori Arrhenius, asam adalah suatu substansi yang dapat melepaskan ion hidrogen (H+) ke dalam larutan, sedangkan basa adalah suatu substansi yang dapat melepaskan ion hidroksida (OH-) ke dalam larutan.

Detail Contoh Teori Asam Basa Arrhenius Koleksi Nomer 16
Zat asam dan basa dijelaskan dalam teori oleh beberapa pakar kimia, di antaranya teori Arrhenius, Bronsted-Lowry, dan Lewis. Asam-basa adalah sifat kimiawi yang dimiliki oleh bahan makanan, minuman, obat-obatan, dan zat lainnya. Disebutkan dalam laman Sumber Belajar Kemdikbud, bahwa secara umum asam mempunyai rasa masam dan basa mempunyai rasa.