
Menentukan Pasangan Asam Basa Konjugasi Teori Asam Basa BronstedLowry / kimia kelas 11 YouTube
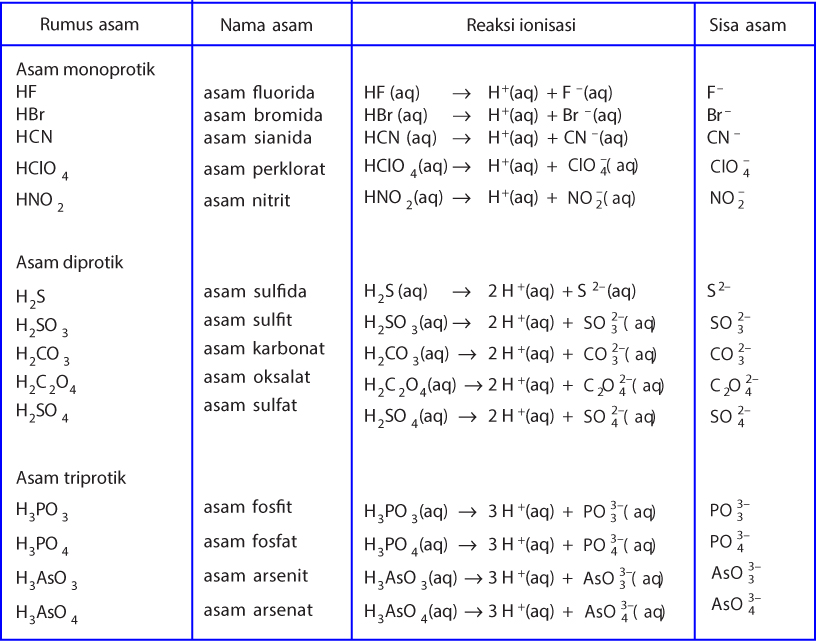
Menurut Teori Bronsted Lowry, asam adalah substansi yang mampu menyumbangkan atau melepaskan ion H+ (proton), sedangkan basa adalah substansi yang mampu menerima ion H+. Dengan kata lain, dalam reaksi kimia, asam akan melepaskan proton dan basa akan menerima proton. Contoh paling sederhana dari reaksi ini adalah reaksi antara asam klorida (HCl.

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
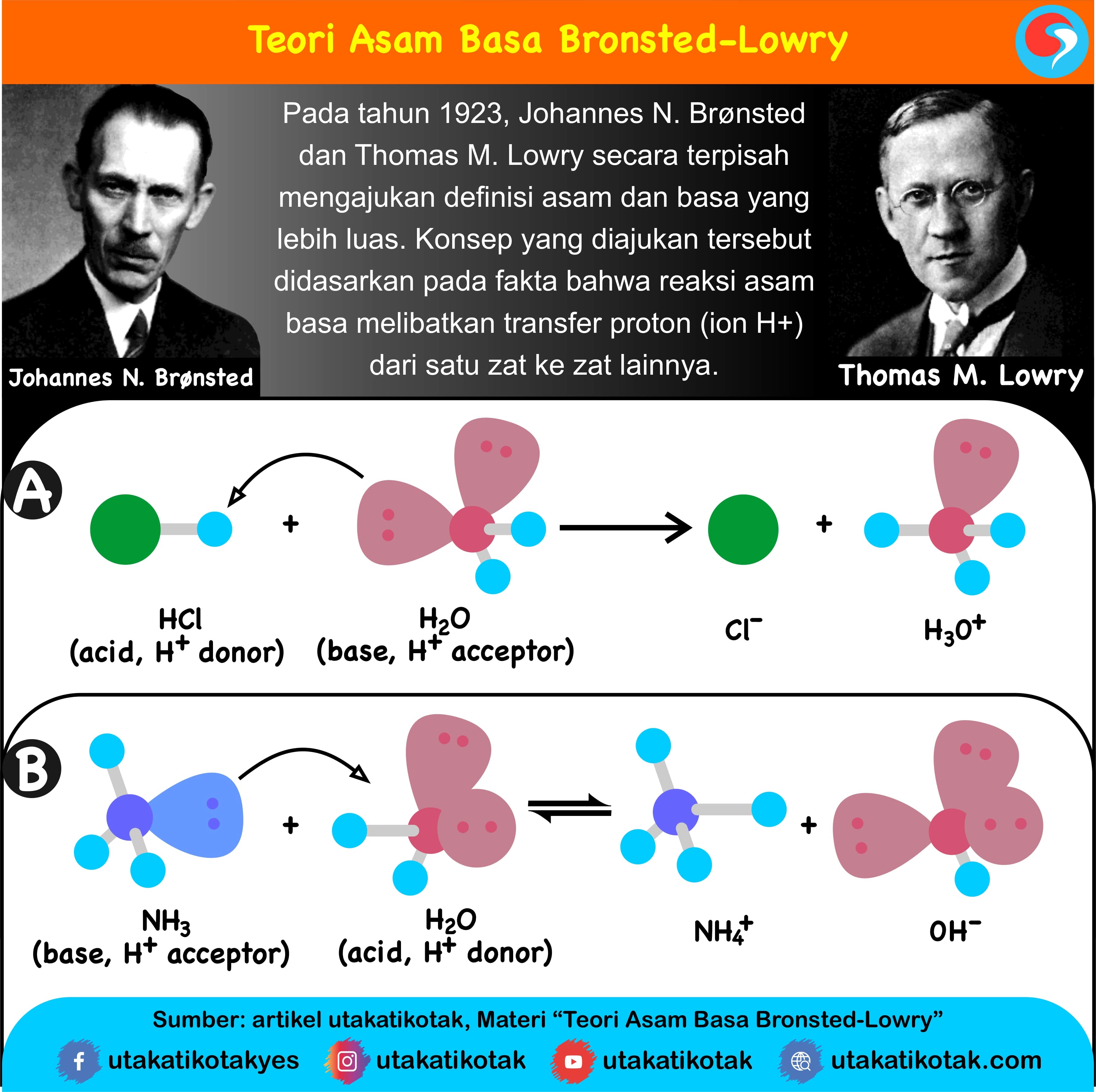
Teori Asam-Basa Bronsted-Lowry. Pada tahun 1923, Johannes Nicolaus Brønsted dan Thomas Martin Lowry secara independen memperkenalkan konsep asam dan basa yang lebih umum. Menurut mereka, asam adalah donor proton (H+), sedangkan basa adalah penerima proton. Teori ini memperluas definisi asam dan basa ke sistem di luar larutan berair.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Pengertian Asam Basa Teori Asam Basa - Lewi, Sarrhenius, Bronsted Lowry [LENGKAP] Asam dan basa adalah dua kelas bahan kimia yang sangat umum di lingkungan kita. Sebagai contoh, cuka, asam sitrat dan asam lambung diklasifikasikan sebagai asam, sedangkan kapur sirih dan soda kaustik diklasifikasikan sebagai alkali.. Menurut Bronsted-Lowry.

Cara Mencari Pasangan Asam Basa Menurut Teori Bronsted Lowry AsamBasa YouTube
Teori Bronsted-Lowry. Teori asam-basa Bronsted-Lowry diperkenalkan secara terpisah oleh Johannes Nicolaus Bronsted (Denmark) dan Thomas Martin Lowry (Inggris) pada tahun 1923. Menurut Bronsted-Lowry, asam didefinisikan sebagai senyawa yang dapat mendonorkan proton (H+), sedangkan basa adalah senyawa yang dapat menerima proton (H+).

Asam Basa Bronsted Lowry (Asam Basa Konjugasi) YouTube
Teori Bronsted-Lewry disebut juga dengan pasangan asam-basa konjugasi. Menurut Lowry, asam dan basa hanya terionisasi di dalam air saja. Hal ini dikarenakan air bisa menarik ion H+ dan membentuk ion hidronium dan air melepas ion H- sehingga membentuk ion hidroksida. Baca juga: Jenis-Jenis Indikator Asam Basa.

Diketahui persamaan reaksi asam basa BronstedLowry berik...
Tetapi, tidak seluruh basa Bronsted Lowry adalah basa dari Arrhenius. Berikut beberapa contoh dari reaksi asam basa dengan pelarut lain selain air pada fase gas. Salah satu contohnya adalah reaksi yang terjadi antara HCl dan NH3. Pada contoh di atas dapat dilihat bahwa reaksi asam basa Bronsted Lowry ada dua pasangan asam basa.

Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
Teori Asam Basa Brønsted-Lowry. Pada tahun 1923, ahli kimia Johannes Nicolaus Bronsted dan Thomas Martin Lowry mengembangkan definisi asam dan basa berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H + ). Menurut konsep Bronsted dan Lowry, zat yang memiliki kecenderungan untuk menyumbangkan ion H+ pada zat lain adalah asam.
Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Definisi asam dan basa. Johannes Nicolaus Brønsted dan Thomas Martin Lowry, secara terpisah, memformulasi ide bahwa asam adalah donor proton (H +) sementara basa adalah akseptor proton. Menurut teori Arrhenius, asam didefinisikan sebagai senyawa yang jika terdisosiasi di dalam larutan akuatik membebaskan H+ (ion hidrogen).

Sintético 104+ Foto Acidos Y Bases De Bronsted Lowry Lleno
Asam klorida akan melepaskan ion H+, sehingga membentuk ion klorida (Cl-) dan meninggalkan ion H3O+ (hidronium) dalam air. Jadi, dalam reaksi ini, asam klorida bertindak sebagai donor proton, sehingga diklasifikasikan sebagai asam menurut konsep Bronsted-Lowry. Pengertian Basa Menurut Bronsted-Lowry
Pengertian Asam dan Basa Menurut BronstedLowr
Sama seperti teori asam basa yang dikemukakan oleh Arrhenius, teori asam basa menurut Bronsted Lowry juga memiliki kelebihan dan kekurangan tersendiri. Teori ini memiliki kelebihan dalam hal cangkupannya yang lebih luar di mana tidak terbatas pada senyawa yang dilarutkan dalam air saja, tapi juga dapat menjelaskan reaksi asam basa dalam pelarut.

Konsep Mudah Belajar Teori Asam Basa BronstedLowry Kimia SMA YouTube
Terdapat beberapa karakteristik khas yang membedakan asam dan basa menurut teori Bronsted-Lowry: 1. Asam: - Asam dapat melepaskan ion H+. - Asam bersifat korosif dan dapat menyebabkan iritasi pada kulit. - Contoh asam umum meliputi asam klorida (HCl), asam sulfat (H2SO4), dan asam asetat (CH3COOH). 2.

Teori Asam Basa
Dari kedua contoh tersebut terlihat bahwa (1) asam Brønsted-Lowry harus mempunyai atom hidrogen yang dapat terlepas sebagai ion H +; dan (2) basa Brønsted-Lowry harus mempunyai pasangan elektron bebas yang dapat berikatan dengan ion H +.. Kelebihan definisi oleh Brønsted-Lowry dibanding definisi oleh Arrhenius adalah dapat menjelaskan reaksi-reaksi asam-basa dalam fase gas, padat.

Teori Asam Basa Bronsted Lowry
Pengertian Asam Basa Brønsted-Lowry. Menurut teori asam basa Brønsted-Lowry, asam adalah donor atau penyumbang proton, dan basa adalah akseptor atau penerima proton. Pengertian ini sebenarnya agak menyesatkan, karena lebih tepat merupakan kompetisi proton antara dua senyawa dengan pemenangnya adalah basa. Teori ini tidak menekankan tingkah.

Teori Asambasa BronstedLowry YouTube
Pengertian basa menurut teori asam basa bronsted-lowry adalah zat atau spesi (ion/molekul) yang menjadi penerima proton (akseptor H+ atau penerima hidrogen). Teori Bronsted-Lowry bisa digunakan saat menjelaskan sifat dari asam basa dengan menggunakan berbagai macam pelarut, tidak hanya air (H2O). Jadi bisa dituliskan bahwa: Asam = donor H+ Basa.

Teori Asam Basa Bronsted Lowry Riset
Konsep asam-basa Bronsted-Lowry tidak terbatas dalam pelarut air, tetapi juga menjelaskan reaksi asam-basa dalam pelarut lain atau bahkan reaksi tanpa pelarut.; Asam-basa Bronsted-Lowry tidak hanya berupa molekul, tetapi juga dapat berupa kation atau anion. Konsep asam-basa Bronsted-Lowry dapat menjelaskan sifat asam dari NH 4 Cl. Dalam NH 4 Cl, yang bersifat asam adalah ion NH 4 + karena.

Asam Basa Teori, Contoh, dan Sifat Asam Basa InformasainsEdu
Sains. Diperbarui pada 01 Maret 2019. Teori asam-basa Brønsted-Lowry (atau teori Bronsted Lowry) mengidentifikasi asam dan basa kuat dan lemah berdasarkan apakah spesies menerima atau menyumbangkan proton atau H + . Menurut teori, asam dan basa bereaksi satu sama lain, menyebabkan asam membentuk basa konjugasinya dan basa membentuk asam.