Tentukan jumlah pasangan elektron terikat, jumlah
Gambar di atas merupakan struktur lewis CH4 yang merupakan senyawa metana. Terlihat pada gambar, atom pusat C memiliki empat pasangan elektron ikatan (PEI) dan tidak memiliki pasangan elektron bebas (PEB). Maka tipe molekulnya yaitu AX4. Demikian pembahasan terkait struktur lewis dalam ikatan kovalen yang perlu diketahui. Semoga bermanfaat ya.

molekul cif3 mempunyai bentuk T . jumlah pasangan elektron ikatan dan pasangan elektron bebas
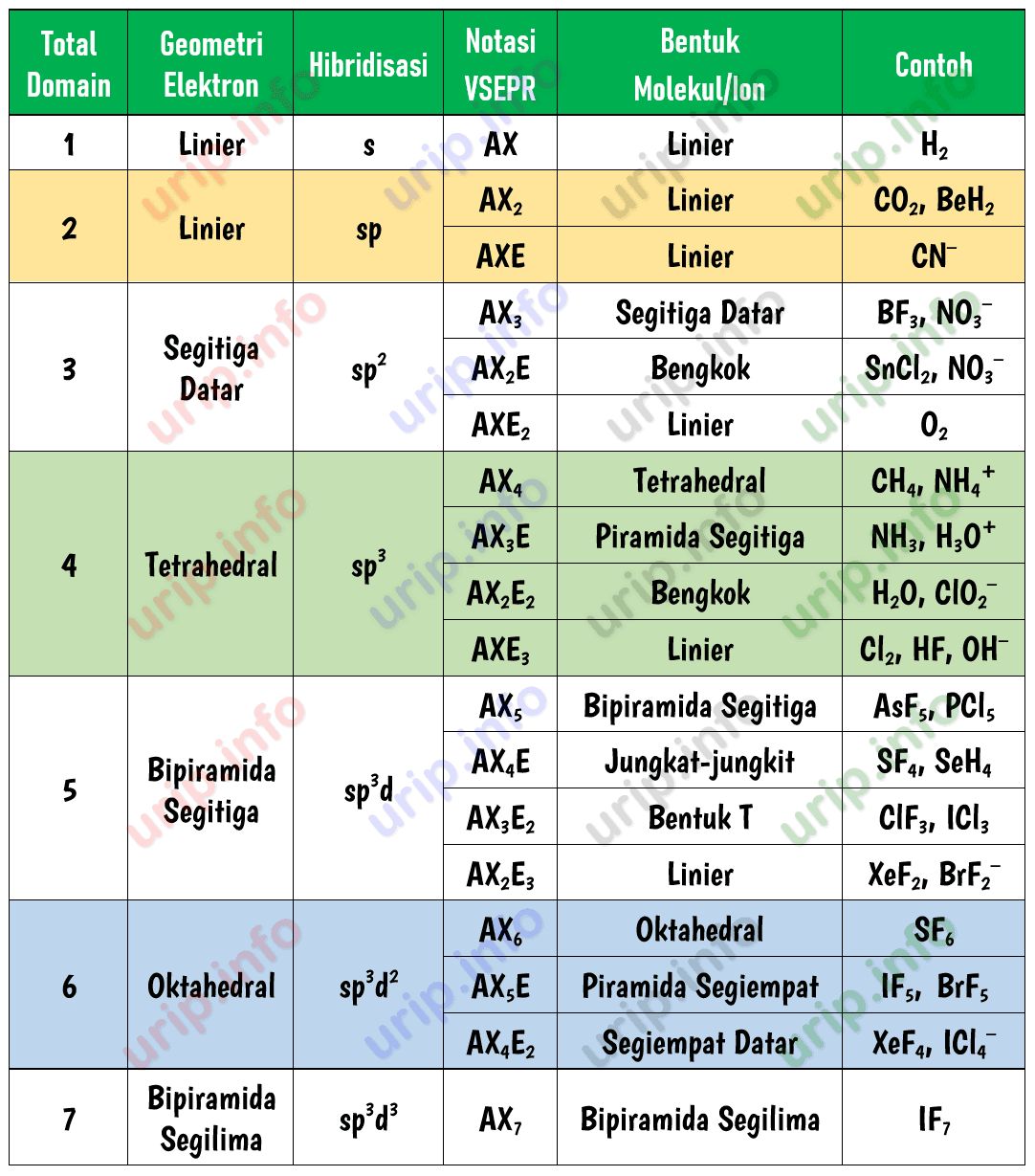
Dari 8 elektron (4 pasang elektron) tersebut, keempatnya merupakan PEI (Pasangan Elektron Ikatan) dengan 1 elekton atom C berikatan dengan 1 elektron atom H. Berdasarkan data pada tabel, kita dapat menyimpulkan bahwa molekul CH$_4$ dengan notasi VSEPR AX$_4$, memiliki bentuk molekul tetrahedron (tetrahedral).

Berdasarkan analisis jumlah pasangan elektron ikatan ( PEI ) dan pasangan elektron bebas ( PEB
Menentukan jumlah pasangan elektron bebas (PEB) atom pusat molekul atau ion poliatom merupakan hal penting ketika ingin memprediksi geometri pasangan elektron dan geometri (bentuk) molekul atau ion poliatom. Dalam sistem AXE atau VSEPR dan juga teori domain elektron keberadaan PEB sangat menentukan bentuk molekul atau bentuk ion poliatom.
Gunakan teori pasangan elektron untuk memperkiraka...
Jumlah pasangan elektron bebas (PEB) dapat dihitung dengan cara mengurangi pasangan elektron atom (PE) dengan pasangan elektron ikatan (PEI). Bilangan sterik. Dilansir dari Lumen Learning, jumlah a dan x disebut dengan bilangan sterik yang dikaitkan dengan jumlah total orbital hibridisasi yang digunakan oleh teori ikatan valensi.
PPT Geometri Molekul dan Gaya Antarmolekul PowerPoint Presentation ID3454498
Kalau ikatan kovalen nonpolar, pasangan elektron ikatannya akan sama kuat ke semua atom, di mana keelektronegatifan antar ikatannya sama. Contohnya adalah atom H yang berikatan dengan atom H lagi, keduanya memiliki nilai keelektronegatifan masing-masing 2,1. Contoh lainnya adalah minyak. Nah, itu dia jenis-jenis ikatan kovalen.

Cara Cepat Menuliskan Konfigurasi Elektron, Golongan, dan Periode YouTube
Teori VSEPR ( Valence Shell Electron Pair Repulsion: "tolakan pasangan kulit elektron valensi") adalah suatu model kimia yang digunakan untuk menjelaskan bentuk-bentuk molekul kimiawi berdasarkan gaya tolakan elektrostatik antar pasangan elektron. [1] Teori ini juga dinamakan teori Gillespie - Nyholm, dinamai atas dua orang pengembang teori ini.
Cara Praktis Menghitung Jumlah Pasangan Elektron Bebas Atom Pusat dalam Molekul atau Ion
2. Ikatan kovalen. Ikatan kovalen terjadi ketika pemakaian bersama pasangan elektron dari masing-masing atom yang berikatan. Contohnya pada ikatan ion H dengan H. Keduanya memerlukan 1 elektron tambahan agar menjadi unsur yang stabil. Oleh karena itu, kedua atom H meminjamkan dan menggunakan bersama-sama satu elektron.

PASANGAN ELEKTRON (PEI DAN PEB) YouTube
Teori Tolakan Pasangan Elektron Kulit Valensi tidak selalu memprediksi geometri molekul yang benar. Contoh pengecualian meliputi: molekul logam transisi (misalnya, CrO 3 adalah trigonal bipiramidal, TiCl 4 adalah tetrahedral) molekul elektron ganjil (CH 3 adalah planar daripada piramida trigonal)

Bentuk molekul/ part 1/ dengan teori tolakan pasangan elektron YouTube
Di dalam ikatan ini, atom yang berkongsi pasangan elektron dari dirinya sendiri dikenali sebagai penderma elektron. Atom yang lain yang menerima pasangan elektron dikenali sebagai penerima. Selepas proses perkongsian elektron, setiap atom akan mencapai kestabilan. Jenis ikatan ini adalah berpandukan teori Lewis. Rujukan: Akash Byjus (2021).

Cara Menentukan Jumlah Pasangan Elektron Pada Konfigurasi Subkulit YouTube
Apabila pasangan elektron hanya berasal dari salah satu atom yang berikatan maka ikatan yang terbentuk ikatan kovalen koordinasi, demikian seperti dikutip modul Kimia. Sementara itu, untuk menggambarkan bagaimana ikatan kovalen terjadi, digunakan rumus titik elektron (struktur Lewis). Yang mana, rumus ini menggambarkan bagaimana peranan.
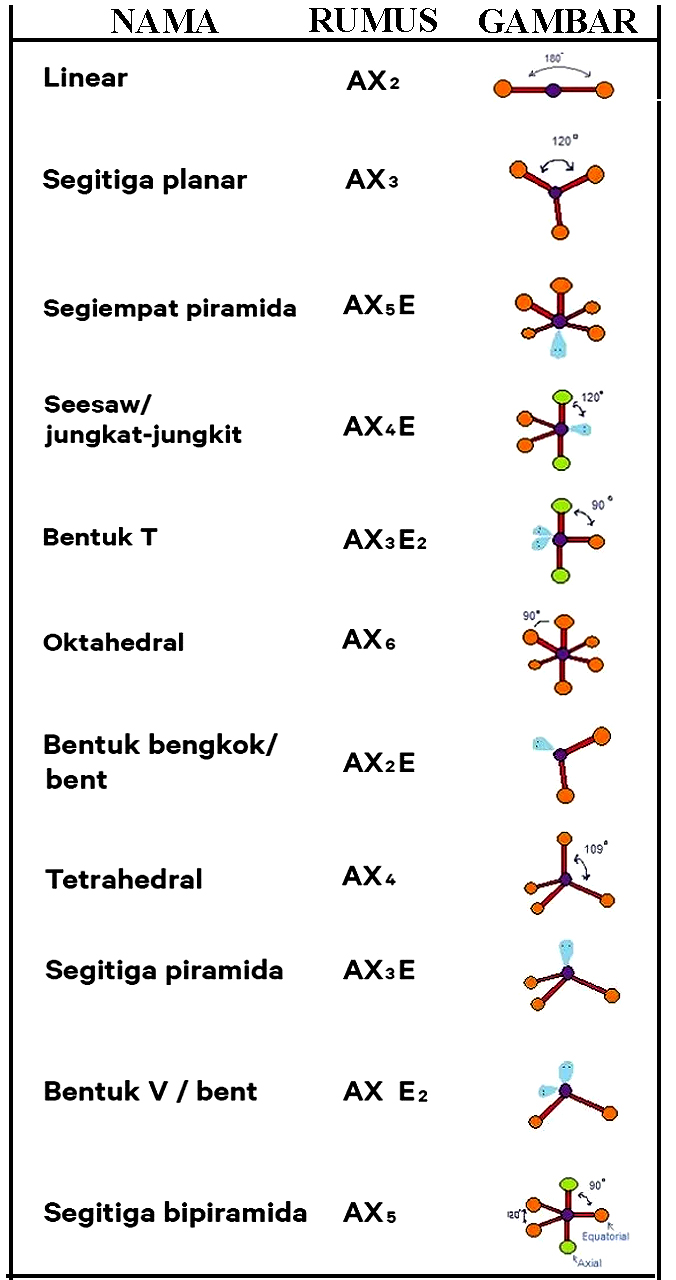
Bentuk Bentuk Molekul Menurut Teori Domain Elektron dan Hibridisasi Anto Tunggal
Perbedaan daya tolak ini terjadi karena pasangan elektron bebas hanya terikat pada satu atom saja, sehingga bergerak lebih leluasa dan menempati ruang lebih besar daripada pasangan elektron ikatan. Akibat dari perbedaan daya tolak tersebut adalah mengecilnya sudut ikatan karena desakan dari pasangan elektron bebas. Hal ini juga terjadi dengan domain yang mempunyai ikatan rangkap atau rangkap.
Tentukan jumlah pasangan elektron terikat, jumlah
Pasangan elektron bebas (PEB) mempunyai gaya tolak yang sedikit lebih kuat daripada pasangan elektron ikatan. Hal itu terjadi karena pasangan elektron bebas hanya terikat pada satu atom, sehingga gerakannya lebih leluasa. Urutan kekuatan tolak-menolak diantara pasangan elektron adalah sebagai berikut.
Suatu molekul mempunyai 5 pasangan elektron di sek...
Ikatan kovalen. Ikatan kovalen adalah sejenis ikatan kimia yang memiliki karakteristik berupa pasangan elektron yang saling terbagi (pemakaian bersama elektron) di antara atom-atom yang berikatan. Singkatnya, stabilitas tarikan dan tolakan yang terbentuk di antara atom-atom ketika mempergunakan bersama elektron dikenal sebagai ikatan kovalen.
Tentukan jumlah pasangan elektron terikat, jumlah
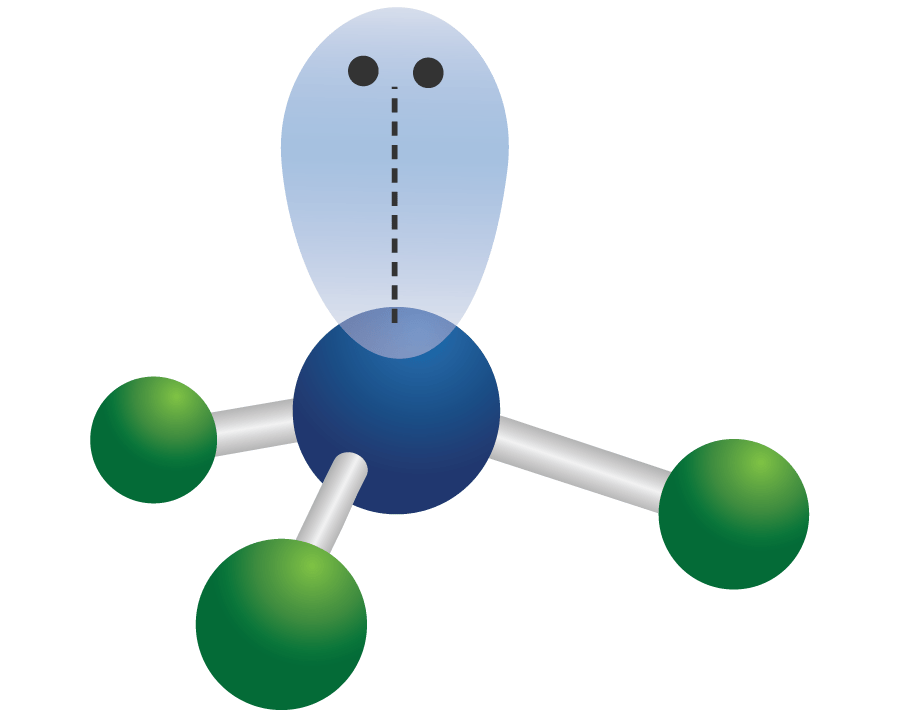
Pasangan sunyi (ditampilkan sebagai pasangan noktah) dalam struktur Lewis hidroksida. Dalam kimia, pasangan elektron sunyi atau disebut juga pasangan sunyi (bahasa Inggris: lone pair) mengacu pada sepasang elektron valensi yang tidak dibagi dengan atom lain dan kadang-kadang disebut pasangan non-ikatan.Pasangan sunyi ditemukan di kelopak elektron terluar suatu atom.
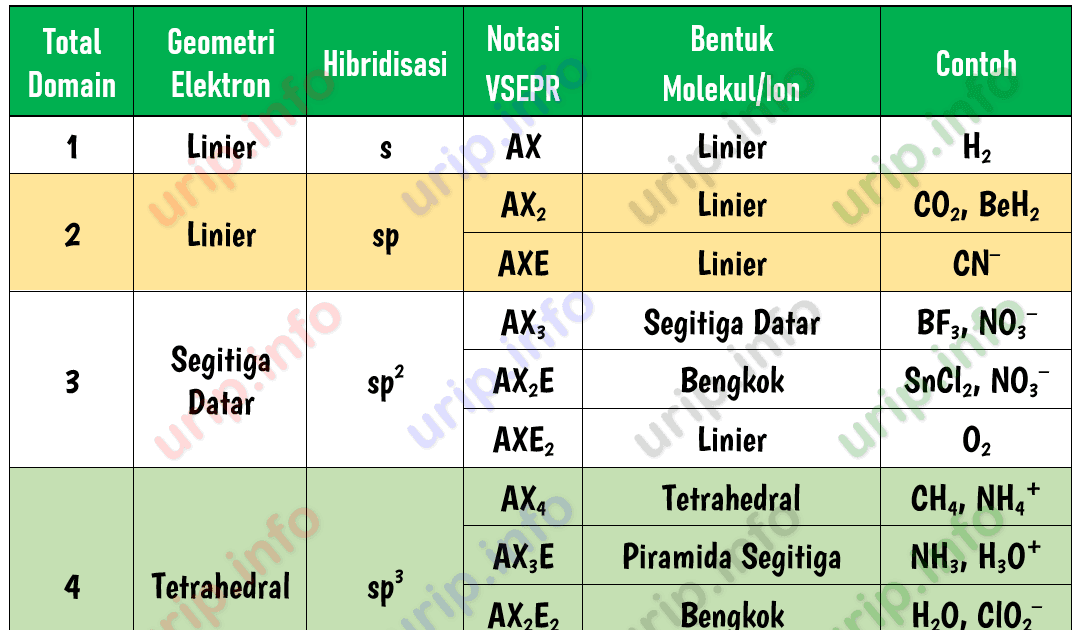
Cara Praktis Menghitung Jumlah Pasangan Elektron Bebas Atom Pusat dalam Molekul atau Ion
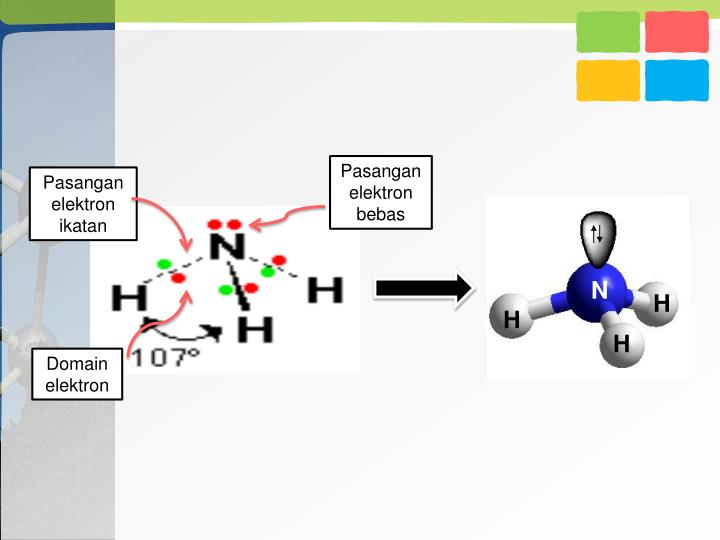
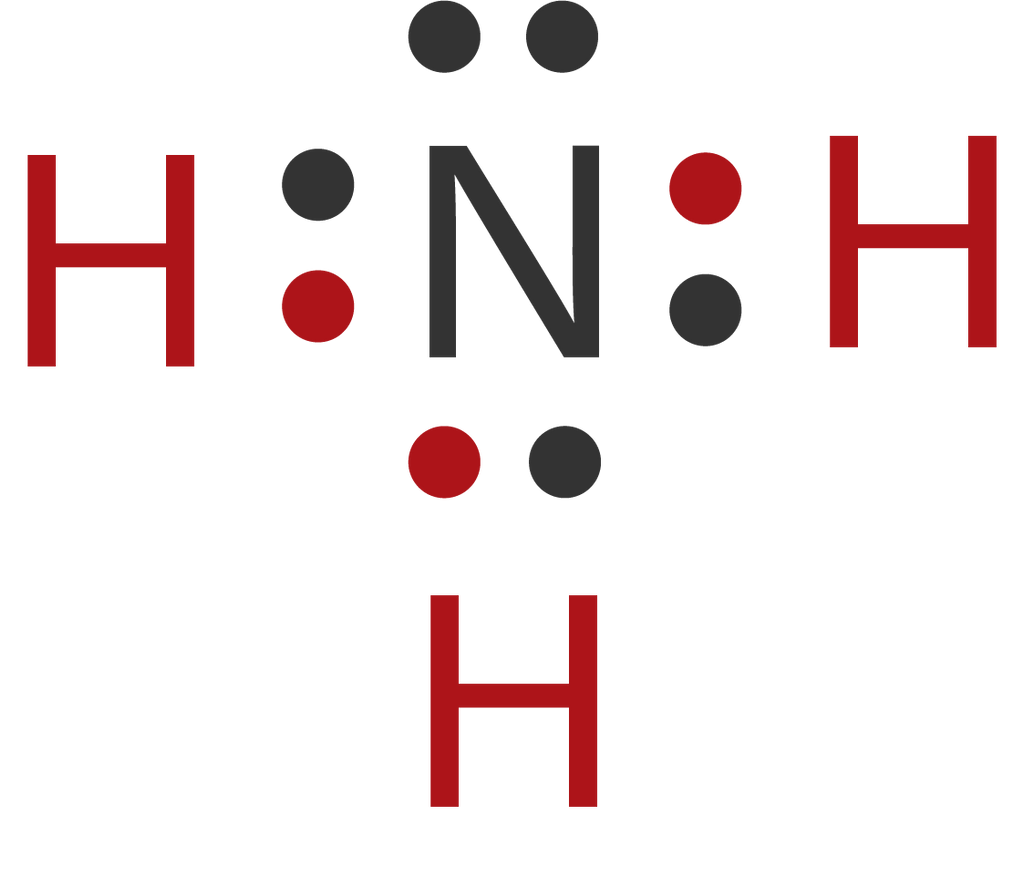
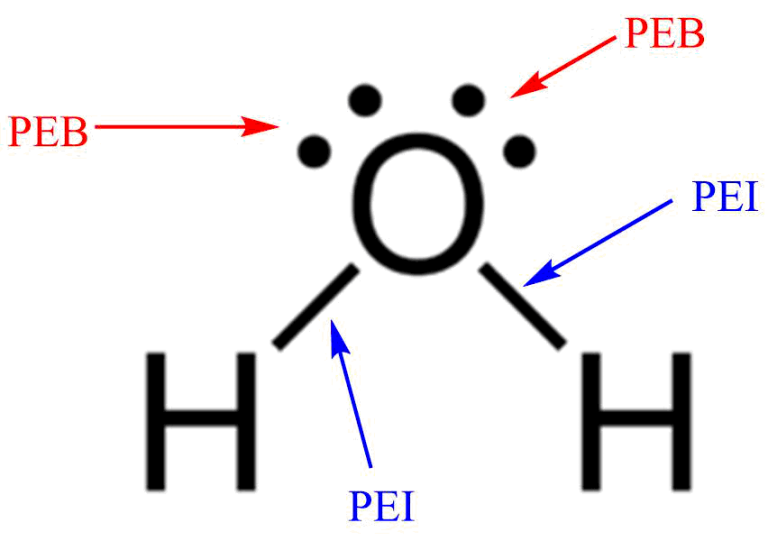
Dalam molekul NH 3 terdapat sepasang elektron yang tidak digunakan (elektron bebas) sehingga disebut Pasangan Elektron Bebas (PEB). Tiga pasang elektron yang digunakan bersama oleh atom N dan atom H disebut Pasangan Elektron Ikatan (PEI). 2. Struktur Lewis Molekul H 2 O. Atom 8 O memiliki konfigurasi elektron 8 O:2, 6.
2 Cara Menentukan Bentuk Molekul Suatu Senyawa Materi Kimia
Teori Bentuk Molekul. 1. Teori VSEPR. Bunyi teori VSEPR adalah pasangan elektron dalam ikatan kimia ataupun pasangan elektron yang tidak dipakai bersama (yaitu pasangan elektron "mandiri") saling tolak-menolak, pasangan elektron cenderung untuk berjauhan satu sama lain.