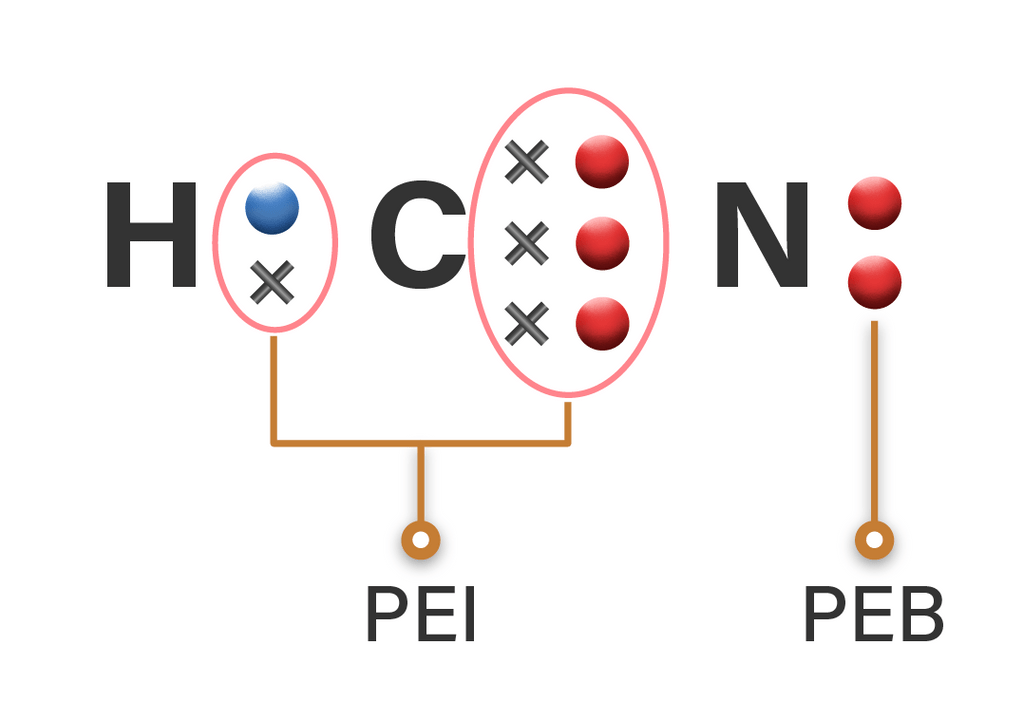
Berapa jumlah pasangan elektron ikatan dan pasanga...
Jumlah elektron dalam Molekul N2 Jumlah elektron yang Terlibat dalam Molekul N2. Molekul nitrogen, juga dikenal sebagai N2, menyimpan rahasia di dalamnya. Terdapat 14 elektron yang saling berinteraksi dan berikatan dalam molekul ini. Setiap atom nitrogen memberikan 7 elektron, sehingga jumlah elektron yang terlibat secara bersama-sama adalah 14.
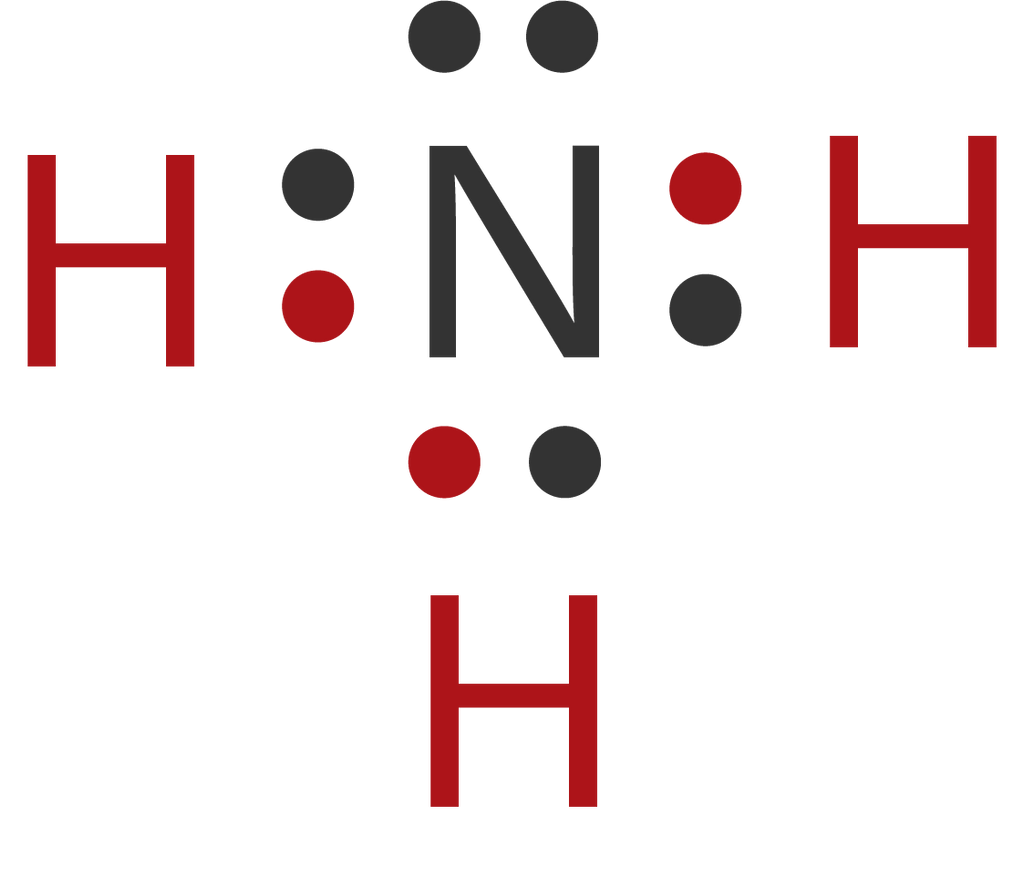
Tentukan jumlah pasangan elektron terikat, jumlah
Dalam molekul NH 3 terdapat sepasang elektron yang tidak digunakan (elektron bebas) sehingga disebut Pasangan Elektron Bebas (PEB). Tiga pasang elektron yang digunakan bersama oleh atom N dan atom H disebut Pasangan Elektron Ikatan (PEI). 2. Struktur Lewis Molekul H 2 O. Atom 8 O memiliki konfigurasi elektron 8 O:2, 6.

Pada molekul N2 (nomor atom N=7) pasangan elektron yang d...
Pembahasan. Molekul nitrogen memiliki rumus kimia N2. Unsur N memiliki konfigurasi elektron 1s 2 2s 2 2p 3, yang menunjukkan adanya 5 elektron valensi. Untuk mencapai kestabilan oktet, dibutuhkan 3 elektron lagi. Oleh karena itu, terjadi penggunaan elektron bersama dengan unsur nitrogen lainnya, di mana setiap unsur menyumbangkan 3 elektronnya.

Pada Molekul N2 Jumlah Pasangan Elektron Ikatan Adalah JumlahID
Contohnya adalah molekul . Nitrogen mempunyai 5 elektron valensi, jadi harus memasangkan 3 elektron untuk mencapai konfigurasi oktet. Pembentukan ikatannya dapat digambarkan sebagai berikut. Berdasarkan gambar di atas, maka pada molekul , jumlah pasangan elektron yang digunakan bersama adalah 3 buah. Jadi, jawaban yang tepat adalah C.

Pasangan Rumus Kimia Dan Nama Senyawa Yang Benar Adalah Homecare24
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Jumlah elektron yang dig.

Pasangan Gambar Yang Merupakan Molekul Senyawa Adalah denah
Sifat yang digunakan untuk membedakan ikatan kovalen polar dengan ikatan kovalen nonpolar adalah elektronegativitas (keelektronegatifan), yaitu kekuatan (kemampuan) suatu atom untuk menarik pasangan elektron yang berikatan. Semakin besar nilai elektronegativitas, semakin besar pula kekuatan atom untuk menarik pasangan elektron pada ikatan.

Berdasarkan analisis jumlah pasangan elektron ikatan (PEI...
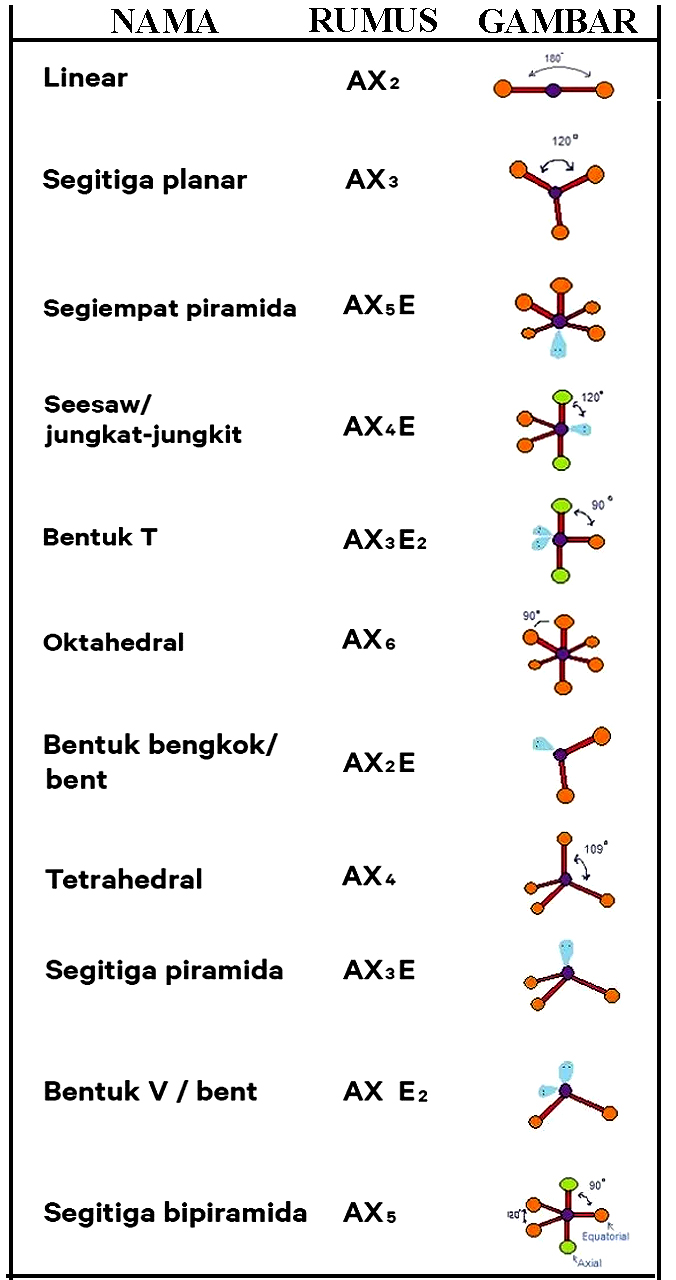
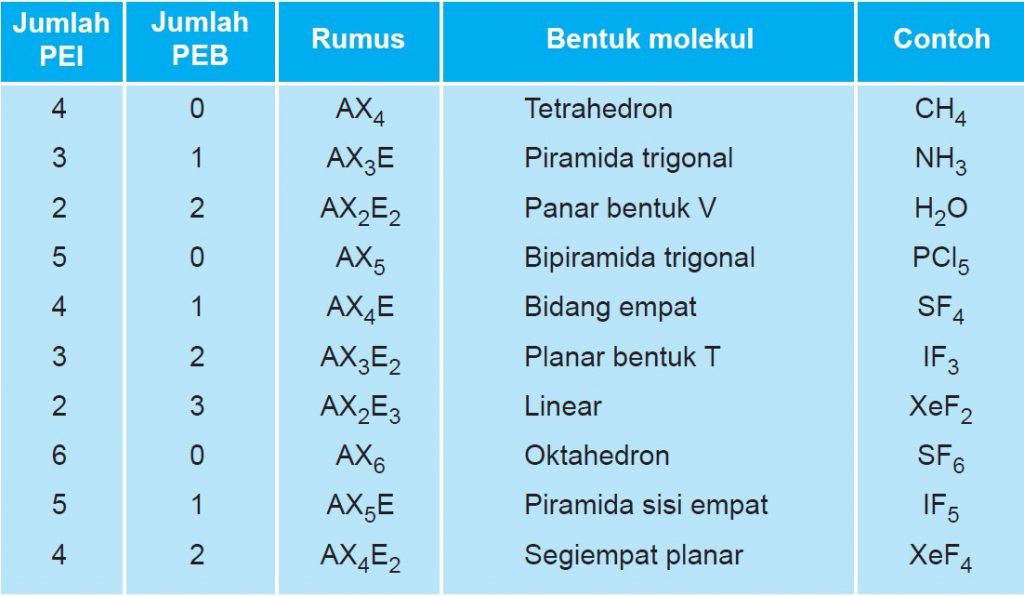
Untuk menentukan bentuk molekul berdasarkan teori domain elektron ini, Quipperian harus mengetahui jumlah pasangan elektron ikatan (PEI) dan pasangan elektron bebas (PEB). PEI adalah pasangan elektron yang digunakan untuk berikatan dengan atom lain, sedangkan PEB adalah pasangan elektron yang tidak digunakan untuk berikatan.

Penjelasan Struktur Atom Proton, Neutron, Elektron dengan Contoh Soal
Kedua atom yang berikatan tersebut akan tertarik pada pasangan elektron yang sama. Pada molekul terjadi ikatan antara atom nonlogam dengan nonlogam dan adanya pemakaian elektron secara bersama yang merupakan ciri ikatan kovalen. Unsur N memiliki elektron valensi 5. Untuk memenuhi kaidah oktet, N membutuhkan 3 elektron.
Bentuk Bentuk Molekul Menurut Teori Domain Elektron dan Hibridisasi Anto Tunggal
Lalu, jika pasangan elektron yang digunakan bersama sebanyak 3 pasang disebut ikatan kovalen rangkap tiga. Contoh ikatan kovalen rangkat dua dan rangkap tiga adalah terjadi pada pembentukan O2 dan N2. a. Pembentukan O2 Konfigurasi elektron 16O adalah 1s2 2s2 2p6 3s2 3p4 sehingga elektron valensinya = 6.

10 107 Sifat molekul N2 YouTube
Hibridisasi dan bentuk molekul bergantung pada jumlah pasangan dari elektron (PE) di sekitar atom pusat. Pasangan elektron terdiri atas pasangan elektron ikatan dan pasangan elektron bebas. Berikut ini adalah langkah-langkah dalam menentukan hibridisasi, diantaranya: Gambarkan diagram elektron valensi atom pusat pada keadaan dasar.

Cara Menghitung Proton Elektron Dan Neutron Ujian
Ikatan kovalen adalah ikatan yang terbentuk dari pemakaian bersama pasangan elektron oleh dua atau lebih atom non logam. Ikatan kovalen ini dibedakan berdasarkan jumlah pasangan elektron dan kepolarannya. Agar lebih jelas, artikel ini akan membahas seputaran ikatan kovalen, mulai dari pengertian, jenis, sifat, hingga cara menggambar ikatan ini.
Materi Bentuk Molekul Berdasarkan Teori VSEPR & Domain Elektron kelas 10 SMA/MA + Latihan Soal
1. Ikatan Kovalen Rangkap Dua. Ikatan ini dibentuk oleh atom-atom nonlogam yang menyumbangkan dua elektron tidak berpasangan untuk berikatan sehingga memenuhi kaidah. Berikut ini beberapa contoh yang memliki kovalen berangkap dua: a. Struktur Lewis Molekul O2. Dalam atom O terdapat dua elektron yang tidak berpasangan.

Cara Menentukan Jumlah Pasangan Elektron Pada Konfigurasi Subkulit YouTube
Model yang sering digunakan untuk menjelaskan ini adalah teori orbital molekul, di mana pasangan elektron dibagikan dalam orbital hibrida yang membentuk ikatan. Dalam kasus N2, ini adalah ikatan sigma dan dua ikatan pi, masing-masing berisi satu pasangan elektron, untuk total tiga pasangan.

Berdasarkan analisis jumlah pasangan elektron ikatan ( PEI ) dan pasangan elektron bebas ( PEB
Pada faktor makroekologi, komponen yang terlihat ialah: 1. Kebutuhan energi makhluk hidup yang memberikan respon terhadap internal tubuh seperti kebutuhan glukosa darah untuk siap dipecah menjadi energi. 2. Rasa lapar yang umum muncul pada makhluk hidup, ini berkaitan dengan rangsangan sekresi HC1 dan enzim

Struktur Lewis Pada Nh3 Yang Tepat Adalah Gambarkan Struktur Lewis Senyawa Kovalen Berikut Ini
Yolamnda Y. Pada molekul N2 jumlah pasangan elektron ikatan adalah .. a. 1 b. 2 c. 3 d. 4 e. 5. Ikatan kovalen rangkap tiga yaitu ikatan kovalen dengan tiga pasang elektron milik bersama. Contohnya pada molekul N 2. Nitrogen mempunyai 5 elektron valensi, sehingga untuk berikatan harus memasangkan 3 elektronnya untuk mencapai konfigurasi oktet.
Bentuk Molekul Berdasarkan Teori Domain Elektron (Teori VSEPR) Materi Kimia
Hal yang harus kamu ingat baik-baik adalah bentuk molekul berdasarkan teori domain elektron ditentukan berdasarkan jumlah PEI dan PEB-nya, di mana keduanya dapat dilihat dari struktur lewisnya. Nah, untuk menentukan bentuk molekul menggunakan teori domain elektron, kamu bisa mengacu pada rumus berikut: AX n E m. Keterangan: A: atom pusat