
Ikatan Kovalen Rangkap Tiga pada Molekul Nitrogen ( N2 ) YouTube
Ikatan kovalen adalah ikatan yang terbentuk dari pemakaian bersama pasangan elektron oleh dua atau lebih atom non logam. Ikatan kovalen ini dibedakan berdasarkan jumlah pasangan elektron dan kepolarannya. Agar lebih jelas, artikel ini akan membahas seputaran ikatan kovalen, mulai dari pengertian, jenis, sifat, hingga cara menggambar ikatan ini.
Bentuk Molekul Berdasarkan Teori Domain Elektron (Teori VSEPR) Materi Kimia
Struktur Orbital Molekul N2 Orde ikatan antar atom adalah separuh dari jumlah elektron yang ada di orbital ikatan dikurangi dengan jumlah yang ada di orbital anti ikatan. Dalam N2, orde ikatannya = (8 - 2)/2= 3 dan nilai ini konsisten dengan struktur Lewisnya Hibridisasi N2 = σ1s2, σ*1s2, σ2s2, σ*2s2, σ2p2, π2py2, π2pz2 = sp3
Bentuk Bentuk Molekul Menurut Teori Domain Elektron dan Hibridisasi Anto Tunggal
Ikatan dengan tiga pasang elektron milik bersama disebut ikatan rangkap tiga. Contohnya adalah molekul . Nitrogen mempunyai 5 elektron valensi, jadi harus memasangkan 3 elektron untuk mencapai konfigurasi oktet. Pembentukan ikatannya dapat digambarkan sebagai berikut. Berdasarkan gambar di atas, maka pada molekul , jumlah pasangan elektron yang.

Berdasarkan analisis jumlah pasangan elektron ikatan (PEI...
2. Diagram orbital molekul N2 N 2 dan O2 O 2. 3. Orde Ikatan. Dalam molecular orbital theory, kestabilan ikatan kovalen berhubungan dengan orde ikatan. Jika nilai orde ikatan lebih besar dari 0, berarti molekul tersebut stabil sedangkan jika nilai orde ikatan sama dengan 0, maka molekul tersebut tidak stabil.

Kestabilan Atom Ikatan Kimia Dan Bentuk Molekul Riset
molekul n2 memiliki ikatan kovalen, sebuah jenis ikatan kimia di mana dua atom saling berbagi sepasang elektron. Dalam kasus molekul N2, dua atom nitrogen berbagi tiga pasang elektron. Proses ini membuat setiap atom nitrogen dapat mencapai kestabilan dengan memiliki delapan elektron pada kulit terluar, yang dikenal sebagai aturan oktet.
Cara Praktis Menghitung Jumlah Pasangan Elektron Bebas Atom Pusat dalam Molekul atau Ion
Dalam kasus N2, ini adalah ikatan sigma dan dua ikatan pi, masing-masing berisi satu pasangan elektron, untuk total tiga pasangan. Keseimbangan dan stabilitas yang ditunjukkan oleh molekul N2, yang memiliki enam elektron valensi per atom, diakui dalam berbagai konteks, termasuk tampaknya tahan terhadap sebagian besar reaktifitas kimia.

Bentuk Molekul berdasarkan Teori Domain Elektron dan Teori Hibridisasi Kimia Kelas 10
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Pada molekul N2, jumlah.

Berdasarkan analisis jumlah pasangan elektron ikatan ( PEI ) dan pasangan elektron bebas ( PEB
Dalam molekul NH 3 terdapat sepasang elektron yang tidak digunakan (elektron bebas) sehingga disebut Pasangan Elektron Bebas (PEB). Tiga pasang elektron yang digunakan bersama oleh atom N dan atom H disebut Pasangan Elektron Ikatan (PEI). 2. Struktur Lewis Molekul H 2 O. Atom 8 O memiliki konfigurasi elektron 8 O:2, 6.

Cara Menentukan Jumlah Pasangan Elektron Pada Konfigurasi Subkulit YouTube
Pembagian Tiga Pasangan Elektron antara Atom Nitrogen dalam N2. Setiap atom nitrogen memberikan tiga pasangan elektron kepada atom nitrogen lainnya dalam molekul N2. Hal ini menghasilkan dua ikatan rangkap antara kedua atom nitrogen, dengan masing-masing ikatan rangkap menggunakan satu pasangan elektron. Dengan demikian, masing-masing atom.
journal of dhamar [IKATAN KIMIA] Bentuk Molekul Berdasarkan Teori Domain Elektron
1. Pengertian Ikatan Kimia. Ikatan kimia adalah gaya tarik menarik yang kuat antara atom-atom tertentu bergabung membentuk molekul atau gabungan ion-ion sehingga keadaannya menjadi lebih stabil. Dua atom atau lebih dapat membentuk suatu molekul melalui ikatan kimia. Ikatan kimia terjadi karena penggabungan atom-atom, yang membentuk molekul.

Rumus Elektron Valensi Molekul Nitrometana Orbital Dan Peranannya Dalam Ikatan Kovalen
Cara Menghitung Orde Ikatan Kimia. Pada level atom, orde ikatan adalah jumlah pasangan elektron terikat di antara dua atom. Misalnya, pada nitrogen dwiatom (N ≡N), orde ikatannya adalah 3 karena ada 3 ikatan kimia yang menautkan dua atom nitrogen. Pada teori orbital molekul, orde ikatan juga diartikan sebagai setengah selisih antara jumlah.

Rumus titik elektron yang menggambarkan ikatan kovalen da...
Banyaknya jumlah elektron terluar (elektron valensi) dari suatu atom menentukan sifat-sifat kimia suatu unsur. Konfigurasi elektron dapat dituliskan dengan cara: 1. Berdasarkan Kulit. Berdasarkan kulit, dapat digunakan rumus konfigurasi elektron 2n2 2 n 2, di mana n menunjukkan kulit atom. Contoh: 11Na 11 N a: 2, 8, 1.
Kedudukan elektronelektron dari atomatom logam d...
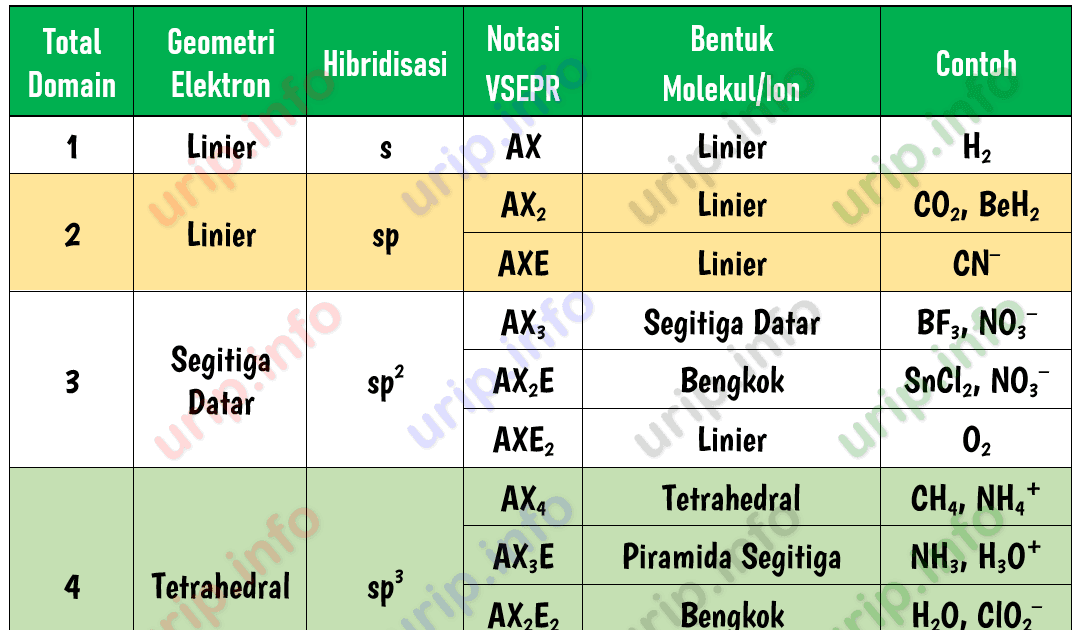
Teori ini didasarkan pada jumlah pasangan elektron ikatan dan pasangan elektron bebas dalam kulit valensi atom pusat suatu molekul. Teori ini menyatakan bahwa bentuk molekul dapat ditentukan berdasarkan tolakan pasangan elektron dalam kulit valensi atom pusat.. Atom pusat pada molekul BF3 adalah boron dengan konfigurasi elektron 5 B: 1s2 2s2.

Ikatan Yang Terbentuk Pada Molekul N2 Adalah cara bertanya yang baik kepada guru
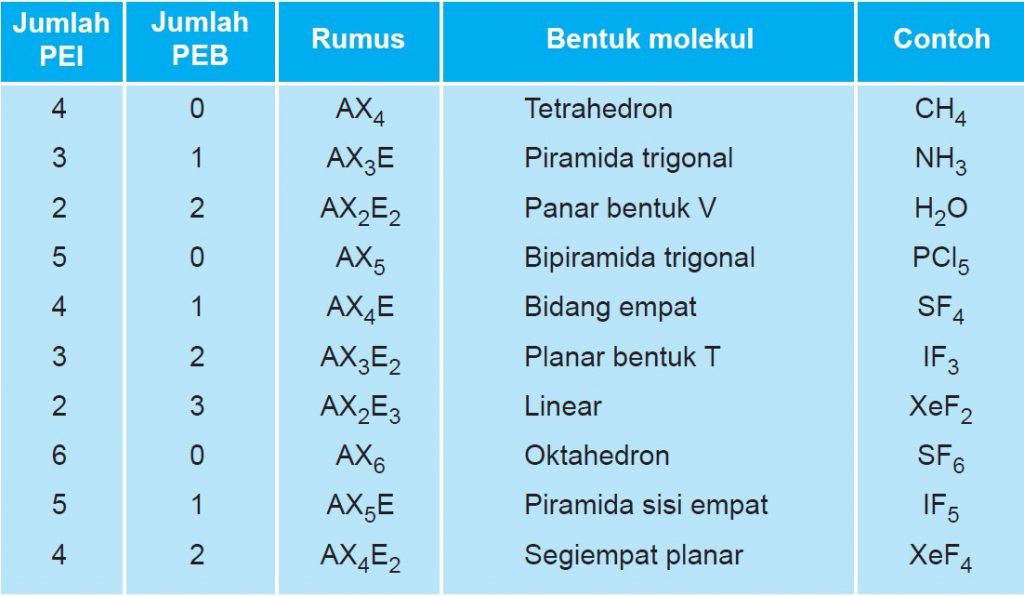
Rumus notasi VSEPR. Notasi VSEPR menentukan bentuk molekul melalui rumus umum yang memperhitungkan jumlah pasangan elektron pada atom. Berikut adalah rumus notasi VSEPR: A: atom pusat. X: Elektron terikat. a: jumlah pasangan elektron ikatan (PEI) yang terikat pada atom pusat. E: kelompok elektron valensi non-ikatan (PEB)
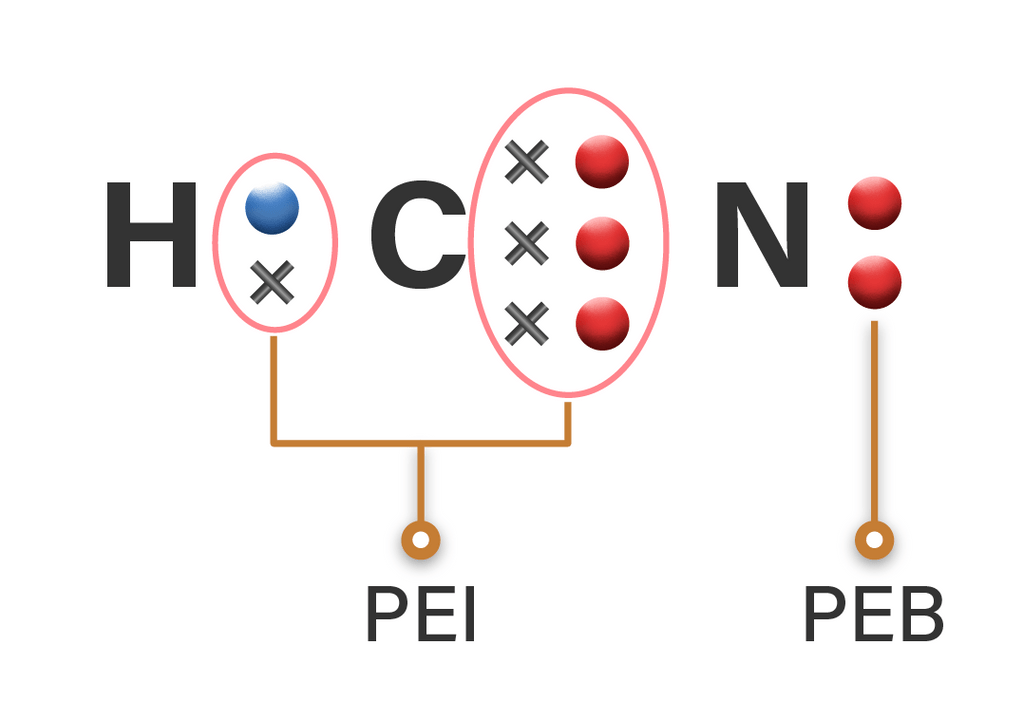
Berapa jumlah pasangan elektron ikatan dan pasanga...
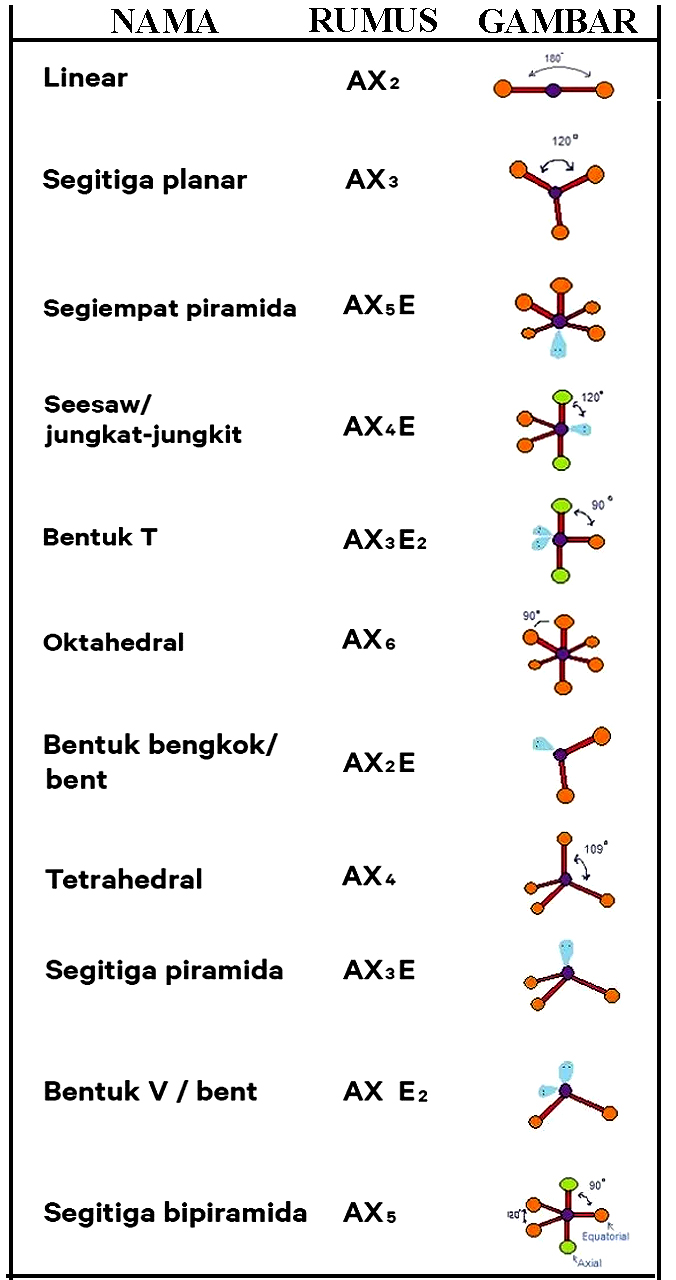
n: jumlah PEI dalam molekul. E: pasangan elektron bebas (PEB) m: jumlah PEB dalam molekul. Ada 11 bentuk molekul berdasarkan teori domain elektron, yaitu linear, segitiga planar, segiempat piramida, seesaw atau jungkat-jungkit, bentuk T, oktahedral, bentuk bengkok, tetrahedral, segitiga piramida, bentuk V, dan segitiga bipiramida.

Salah satu cara memprediksi bentuk molekul adalah dengan
Kedua atom yang berikatan tersebut akan tertarik pada pasangan elektron yang sama. Pada molekul terjadi ikatan antara atom nonlogam dengan nonlogam dan adanya pemakaian elektron secara bersama yang merupakan ciri ikatan kovalen. Unsur N memiliki elektron valensi 5. Untuk memenuhi kaidah oktet, N membutuhkan 3 elektron.