
Konsep Bilangan Kuantum, Cara Memahami dan menyusunnya Sains Pedia
Bilangan kuantum (Inggris: Quantum number) adalah bilangan yang menyatakan kedudukan atau posisi elektron dalam atom yang diwakili oleh suatu nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum menggambarkan sifat elektron dalam orbital.. Bilangan kuantum menentukan tingkat energi utama atau jarak dari inti, bentuk orbital, orientasi orbital, dan spin elektron.

Cara Mencari Bilangan Kuantum Kimia Kelas 10
Untuk menentukan jumlah total orbital yang mungkin dalam suatu subkulit dengan nilai l tertentu, kamu dapat menggunakan rumus 2l + 1. Dalam hal ini, l = 3. Jadi, jumlah total orbital yang mungkin pada subkulit dengan bilangan kuantum azimut l = 3 adalah 2 × 3 + 1 = 7 orbital. Demikian Contoh Soal Bilangan Kuantum Utama, Azimut, Magnetik, dan Spin

Konfigurasi Elektron Dalam Orbital Untuk Unsur 18Ar Adalah Ujian
Bilangan kuantum utama menyatakan tingkat energi utama elektron suatu atom atau menunjukkan kulit atom. Kalau Sobat Zenius ingat model atom Bohr, bilangan dengan lambang "n" ini melambangkan kulit atomnya, nih. Nah, Sobat Zenius, gue punya rekomendasi video materi singkat yang ngebahas soal bilangan kuantum utama, nih.

Harga bilangan kuantum yang mungkin untuk suatu orbital a...
KOMPAS.com - Bilangan kuantum adalah bilangan yang menggambarkan kedudukan suatu elektron dalam model atom mekanika kuatum yang dicetuskan oleh Erwin Schrodinger.. Dilansir dari Khan Academy, model atom mekanika kuantum berangkat dari hipotesis Louis de Broglie dan prinsip ketidakpastian Heisenbersg.. Model atom mekanika kuantum adalah model atom yang paling diyakini karena bisa menjelaskan.
Modul, Rumus, & Soal Orbital & Bilangan Kuantum Wardaya College
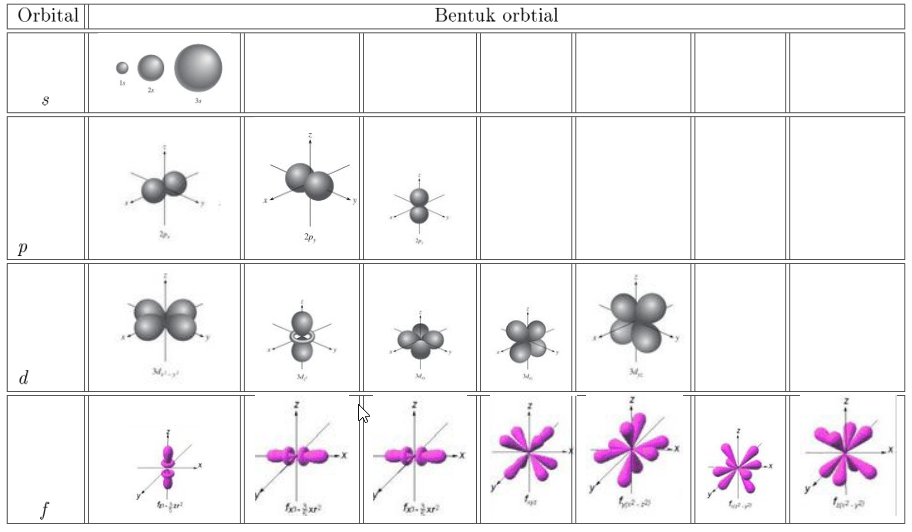
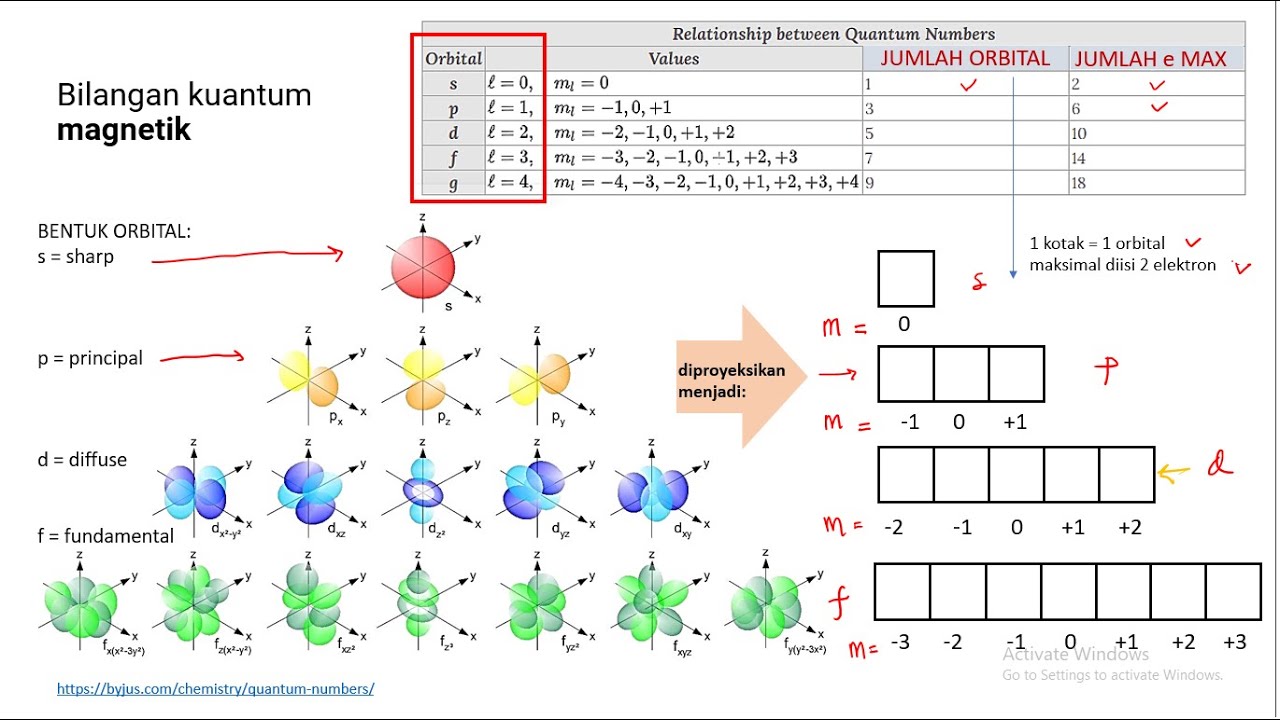
Nilai yang mungkin untuk l adalah bilangan bulat dari 0 sampai n − 1 (dimana n adalah bilangan kuantum utama elektron): l = 0 , 1 ,. , n − 1. {\displaystyle l=0,1,\ldots ,n-1.} Bentuk tiap orbital biasanya mengacu ke huruf dan bukan bilangan kuantum azimutnya.

Suatu unsur memiliki notasi 52 24Cr. Diagram orbital yang...
Yuk, belajar cara mencari bilangan kuantum dengan mudah melalui artikel Kimia kelas X berikut ini! —. Sadar nggak sih, kalau dunia kita ini penuh sekali akan berbagai hal yang teratur dengan rapi. Mulai dari matahari yang terbit dari arah Timur hingga terbenam ke arah Barat. Kemudian, ada bumi yang mengelilingi matahari dalam dua belas bulan.
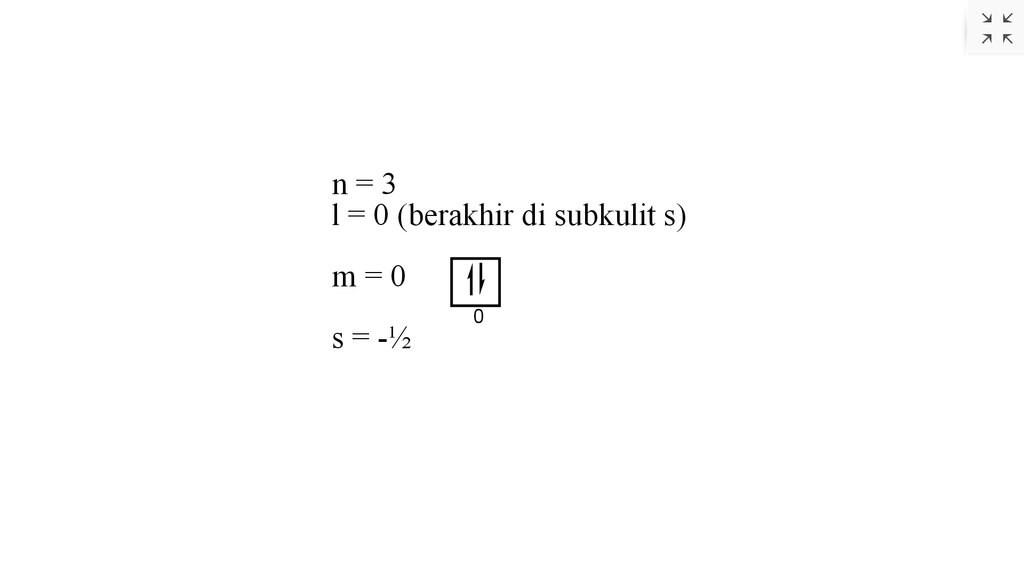
bilangan kuantum yang mungkin untuk elektron terak...
Bilangan kuantum utama dan bilangan kuantum azimut ditentukan dengan melihat konfigurasi elektron terakhir dari suatu atom. Konfigurasi elektron yang dimaksud adalah konfigurasi berdasarkan subkulit atom. Adapun bilangan kuantum magnetik dan bilangan kuantum spin dapat ditentukan dengan membuat diagram orbital terlebih dahulu. Namun jika sudah.

Nilai keempat bilangan kuantum elektron terakhir dari ato...
Contoh: Untuk l=0, maka m= 0. Untuk l=1, maka m= -1, 0, +1. Untuk l=2, maka m= -2, -1, 0, +1, +2. 4. Bilangan kuantum spin (s) Menggambarkan arah rotasi atau putaran elektron dalam satu orbital. Dimana hanya ada 2 arah putaran yang mungkin yaitu searah jarum jam dan berlawanan jarum jam, maka setiap orbital dapat memuat 2 elektron dengan arah.

Kimia Kelas 10 Bilangan Kuantum Spin Bit CDN
Bilangan kuantum utama adalah bilangan kuantum primer yang difungsikan untuk menyatakan berapa tingkat energi yang telah dimiliki oleh elektron didalam sebuah atom. Perlu diingat, bahwa bilangan kuantum tidak pernah bernilai nol (0).. Bilangan kuantum spin merupakan dasar pengisian elektron dalam suatu orbital,. Nilai m = antara -1 dan +1.

Subkulit Yang Tidak Mungkin Ada Dalam Suatu Atom Adalah Tugas sekolah
Bilangan kuantum utama ( n) Nilai n pada konfigurasi elektron adalah angka di depan subkulit yang menyatakan jumlah kulit. Untuk konfigurasi elektron 4 d, nilai n = 4. Bilangan kuantum azimut ( l) Konfigurasi elektron: 4d l = d l = 2. Bilangan kuantum magnetik ( m) l = 2 m = −2, −1, 0, +1, +2 (5 orbital) Bilangan kuantum spin ( s)

Diantara serial bilangan kuantum berikut, yang menjelaskan orbital 4f adalah Soal OSNK Kimia
Nilai m l yang diperbolehkan adalah bilangan bulat dari −l hingga +l. Bilangan kuantum spin (m s) mendeskripsikan arah spin elektron dalam orbital. Nilai m s yang diperbolehkan adalah +½ atau −½. Kombinasi bilangan kuantum n, l, dan m l yang mungkin pada 4 kulit elektron pertama dapat dilihat pada tabel berikut: Bentuk Orbital Atom Orbital s

Kelas X Struktur Atom 4 Bilangan Kuantum dan Bentuk Orbital YouTube
Nilai bilangan kuantum azimuth sama dengan jumlah total sudut dalam orbital. Bilangan ini digambarkan dalam nilai berkisar antara 0 hingga n-1 dimana n adalah bilangan kuantum utama. Bilangan kuantum azimuth dapat menunjukkan subkulit s, p, d, atau f yang ditempati oleh elektron. Sebagai contoh yaitu ketika nilai bilangan kuantum utama n = 3.
3 Bilangan Kuantum dan Konfigurasi Elektron Atom dan Sistem Periodik Unsur Kimia SMA X
Bilangan kuantum spin. Bilangan kuantum spin adalah bilangan kuantum keempat yang dilambangkan dengan ms atau s. Disadur dari Thought Co, bilangan kuantum spin menunjukkan orientasi momentum sudut intrinsik elektron dalam atom. Bilangan kuantum spin ditemukan oleh Otto Stern dan Walter Gerlach melalui eksperimennya pada tahun 1920.

Cara Mencari 4 Bilangan Kuantum
Untuk subkulit d, ada 5 nilai m l, yaitu -2, -1, 0, +1, dan +2. Bilangan kuantum ms atau bilangan kuantum spin menyatakan orientasi elektron dalam orbital. Ada 2 nilai m l, yaitu jika searah jarum jam, nilai m s = dan jika berlawanan arah jarum jam, nilai m s = . Berdasarkan analisis tersebut, nilai bilangan kuantum yang paling sesuai adalah .

Konsep Bilangan Kuantum, Cara Memahami dan menyusunnya SainsPedia
Jadi agar suatu elektron memiliki nilai bilangan kuantum magnetik (m ) = - 3, maka atom itu harus memiliki setidaknya 4 buah kulit atom. Contoh Soal 9. Diantara harga keempat bilangan kuantum di bawah ini yang mungkin untuk pengisian elektron pada orbital 3p adalah . . . . . n = 3, l = 2, m = -1, s = +1/2; n = 3, l = 1, m = -1, s = +1/2

Cara Menentukan Bilangan Kuantum Elektron Terakhir dari Unsur Besi (26Fe) Mekanika Kuantum
Berdasarkan penjelasan, nilai bilangan kuantum yang mungkin untuk elektron yang berakhir pada subkulit 4d adalah n = 4, l = 2, m = 0, s = + 2 1 . Jadi, jawaban yang tepat adalah A. Tahun 1927, W. Heisenberg mengemukakan prinsip ketidakpastian yaitu posisi elektron yang mengelilingi inti atom tidak dapat ditentukan secara pasti.