
Derajat hidrolisis dari larutan NH4Cl 0,001 M adalah(...
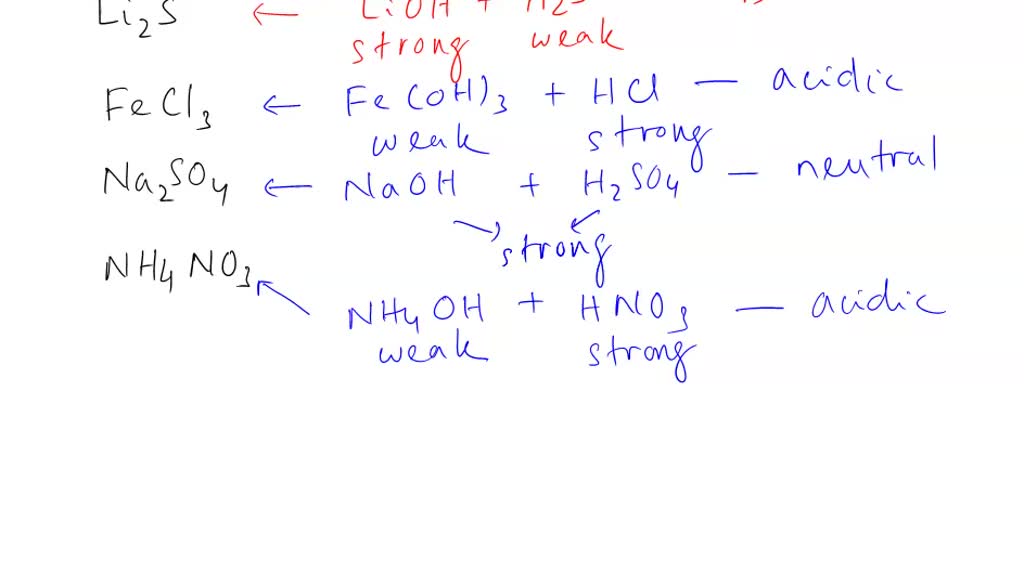
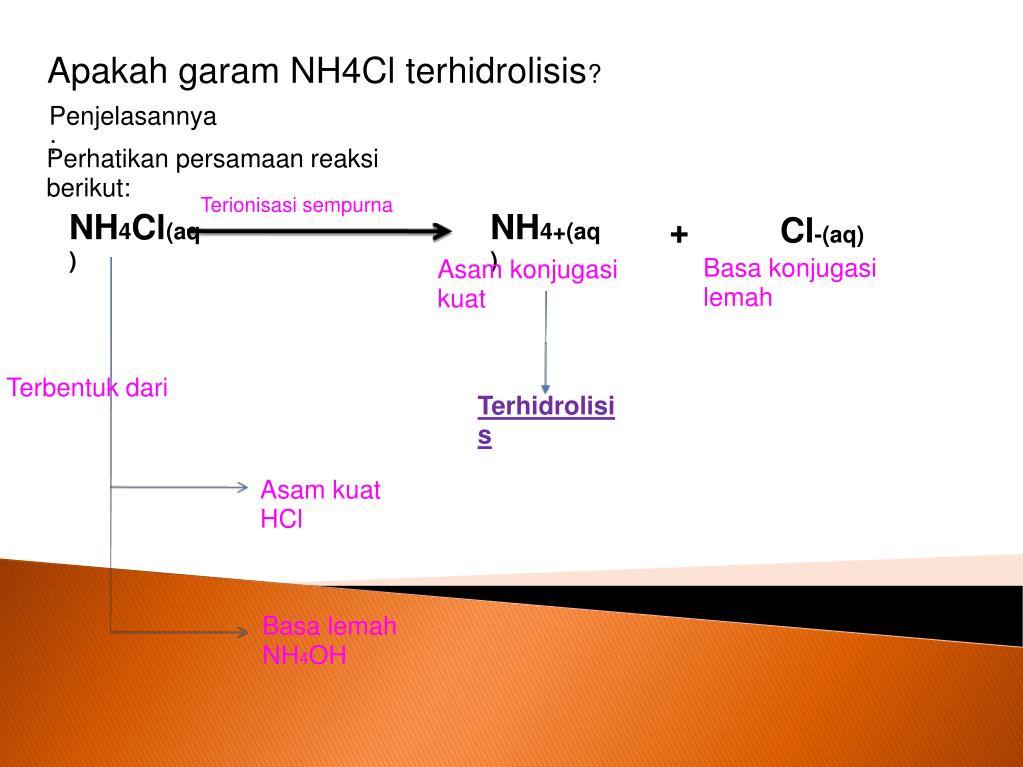
2. Garam yang Berasal dari Basa Lemah dan Asam Kuat. Garam seperti NH 4 Cl yang dapat terbentuk dari reaksi asam kuat (HCl) dan basa lemah (NH 3) akan mengalami hidrolisis kation yang berasal dari basa lemah sehingga larutannya bersifat asam.Anion Cl − tidak terhidrolisis karena merupakan basa konjugasi yang sangat lemah.. Kation NH 4 + dapat terhidrolisis karena merupakan asam konjugasi.

Reaksi hidrolisis garam NH4 Cl adalah
1. Hidrolisis parsial. Hidrolisis parsial ialah ketika garam direaksikan dengan air hanya salah satu/sebagian ion saja yang mengalami reaksi hidrolisis, sedangkan yang lainnya tidak. Komponen penyusun garam yang mengalami reaksi hidrolisi parsial ini ialah asam lemah dan basa kuat atau sebaliknya. 2. Hidrolisis total.
SOLVED tentukan sifat larutan garam,jenis hidrolisis,dan reaksi terhidrolisis dari CaCl2 NH4Cl
Ketika terjadi reaksi antara komponen asam basanya, maka air akan melepas ion OH- dan OH+. Garam yang mengalami hidrolisis sebagian atau parsial adalah: - Garam yang terbentuk reaksi hidrolisis asam lemah dan basa kuat, - atau dari basa lemah ke asam kuat. Supaya lebih jelas, coba kamu cermati reaksi kimianya berikut ini. NH4Cl → NH4.

Pasangan persamaan reaksi hidrolisis yang bersifat basa adalah Universityku
MODUL HIDROLISIS. iriani wulandari. HIDROLISIS berasal dari kata hydro yang berarti air dan lysis yang berarti peruraian HIDROLISIS adalah komponen garam (kation dan anion) bereaksi dengan air. Reaksi pembentukan garam, antara lain : 1. Garam dari Asam kuat dan Basa kuat Contoh : NaCl NaCl (aq) → Na+ (aq) + Cl- (aq) Na + (aq) + H 2 O (l) →.

Kelompokkan garamgaram berikut yang mengalami hidrolisis...
Nah, kalau hidrolisis parsial terdiri dari asam lemah, basa kuat atau asam kuat, basa lemah. Intinya hanya ada satu komponen yang lemah ya. Contoh garam yang mengalami hidrolisis sebagian dan bersifat asam adalah NH4Cl atau ammonium Klorida.

Garam NH4Cl mengalami hidrolisis parsial. Reaksi hidrolis...
Garam dari asam kuat dan basa lemah akan mengalami hidrolisis sebagian. Misalnya ammonium klorida (NH4Cl) yang terbentuk dari asam kuat dan basa lemah, yaitu asam klorida (HCl) dan ammonia (NH3). Amonia akan mengalami ionisasi terurai menjadi ion NH4+ dan Cl-. Baca juga: Senyawa Hidrokarbon: Pengertian, Rumus, Golongan, dan Contohnya

Contoh Soal Hidrolisis Garam Homecare24
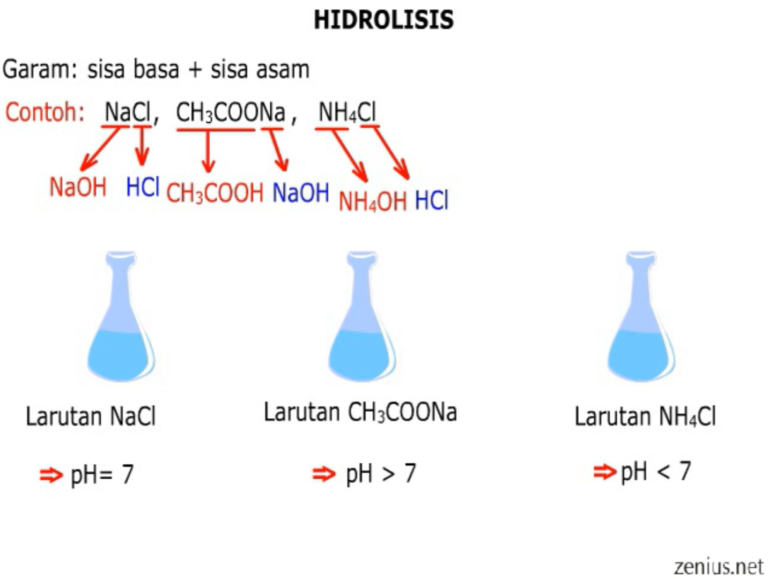
Hidrolisis garam merupakan reaksi reversible penguraian garam oleh air. Reaksi ini bekerja pada salah satu ion-ion garam (kation atau anion) dengan air sehingga membentuk larutan bersifat asam atau basa. Sifat asam atau basa yang dihasilkan pun bergantung pada jenis asam basa yang membentuk garam tersebut. Misalnya garam yang terbentuk dari.

pH de NH4Cl (sales que sufren hidrólisis) YouTube
Garam yang berasal dari asam kuat dan basa lemah dalam air akan bersifat asam (pH < 7) karena mengalami hidrolisis sebagian, contohnya adalah NH4Cl. Dalam air, NH4Cl akan terionisasi dan ion NH4+ yang dihasilkan akan bereaksi dengan air, sedangkan ion Cl- tidak akan bereaksi dengan air sebab berasal dari asam kuat.

Nilai Tetapan Hidrolisis Kh Dari Nh4cl 0 1 M Kb Nh3 = 1 8 Kali 10 Pangkat Min 5 Adalah
Senyawa NH4Cl dalam air dapat mengalami hidrolisis parsial dan bersifat asam dengan reaksi sebagai berikut. Reaksi ionisasi : NH4Cl --> NH4+ + Cl- Ion NH4+ berasal dari basa lemah yaitu NH4OH, sementara ion Cl- berasal dari asam kuat yakni HCl, maka reaksi hidrolisisnya yaitu: NH4+ + H2O ↔ NH4OH + H+ (adanya ion H+ menunjukkan bahwa larutan.

Dari Garam Berikut Yang Mengalami Hidrolisis Total Adalah Sekolah Siswa Riset
Menentukan jenis garam yang mengalami hidrolisis dalam air dan pH Kompetensi Dasar larutan garam tersebut.. NH4+(aq) + Cl-(aq) Contoh larutan garam yang bersifat asam adalah NH4Cl. Perhatikan reaksi hidrolisis NH4+ berikut ini : NH4+(aq) + H2O(l) NH4OH(aq) + H+(aq) Konstanta kesetimbangan reaksi hidrolisis disebut konstanta hidrolisis yang.

Garam Berikut Yang Mengalami Hidrolisis Sebagian Adalah Blog Yuri
Nah, garam berikut yang tidak mengalami hidrolisis adalah NaCl (natrium klorida), KCl (kalium klorida), dan KNO3 (kalium nitrat).. Contoh dari senyawa garam jenis ini adalah NH4Cl yang merupakan garam yang terbentuk dari asam kuat HCl dan basa lemah NH4OH. Asam Lemah - Basa Lemah.
Garam Yang Mengalami Hidrolisis Dan Sesuai Dengan Uji Lakmusnya Adalah
Oleh karena itu, larutan garam dari asam lemah dan basa kuat akan meningkatkan konsentrasi OH − dalam air sehingga larutannya bersifat basa (pH > 7).. Garam dari asam lemah dan basa lemah. Garam seperti CH 3 COONH 4 yang dapat terbentuk dari reaksi asam lemah (CH 3 COOH) dan basa lemah (NH 3) akan mengalami hidrolisis kation dan anionnya. pH larutan garam demikian bergantung pada kekuatan.

Tabel pengujian larutan yang mengalami hidrolisis sebagai...
Haikal Friends disini kita ada soal di mana garam nh4cl mengalami hidrolisis parsial reaksi hidrolisis yang terjadi adalah jadi garam nh4cl ini terbentuk dari basa lemah yaitu nh4oh dan asam kuat HCL garam nh4cl mengalami reaksi penguraian menjadi ion nh4 + dan CL Min di mana ion garam nh4 + ini dapat mengalami hidrolisis menjadi nh4oh dan H plus Nah di sini karena pada hidrolisisnya.

Tabel hasil pengujian larutan yang mengalami hidrolisis s...
Hidrolisis parsial atau sebagian bisa terjadi ketika garam dari asam lemah dan basa kuat atau sebaliknya. Pada hidrolisis sebagian ini, hanya salah satu ion yang akan mengalami reaksi hidrolisis dan yang lainnya tidak. Contohnya adalah garam NH 4 Cl, ketika di dalam air NH 4 Cl akan terionisasi sempurna membentuk ion Cl dan juga NH 4 +.

Pasangan senyawa berikut yang mengalami hidrolisis total
Sedangkan hidrolisis sebagian terbentuk karena adanya salah satu ion saja yang mengalami hidrolisis. Sebagai contoh adalah garam NH4Cl yang terionisasi sempurna menjadi Cl- dan NH4+. Hidrolisis Total; Hidrolisis total adalah hidrolisis yang terjadi apabila garam berasal dari asam lemah dan basa lemah sehingga terjadi ionisasi sempurna dalam air.
PPT Hidrolisis didefinisikan sebagai reaksi dengan air PowerPoint Presentation ID3918911
NH4Cl → NH4+ + Cl-. Ikatan amida kurang rentan mengalami hidrolisis dibanding ikatan ester karena karbon karbonil pada amida kurang elektrofilik (ikatan karbon dengan nitrogen dianggap sebagai ikatan ganda) dan gugus amin sebagai leaving group, merupakan leaving group lemah. Obat-obatan seperti paracetamol, kloramfenikol, linkomisin.