
Contoh Soal Molaritas Dan Pembahasannya
Maka, jawabannya adalah n p = d. 0,8 mol. 2. Suatu larutan, memiliki fraksi mol zat terlarut sebesar 0,2. Jika ke dalam larutan tersebut ditambahkan lagi zat terlarut yang sama sebanyak 0,2 mol, fraksi mol zat terlarutnya menjadi 1 / 3. Maka banyaknya mol zat terlarut awal dalam larutan tersebut adalah…. a. 0,1 mol. b. 0,2 mol. c. 0,3 mol. d.
Berapa mol yang terdapat dalam atom/molekul beriku...
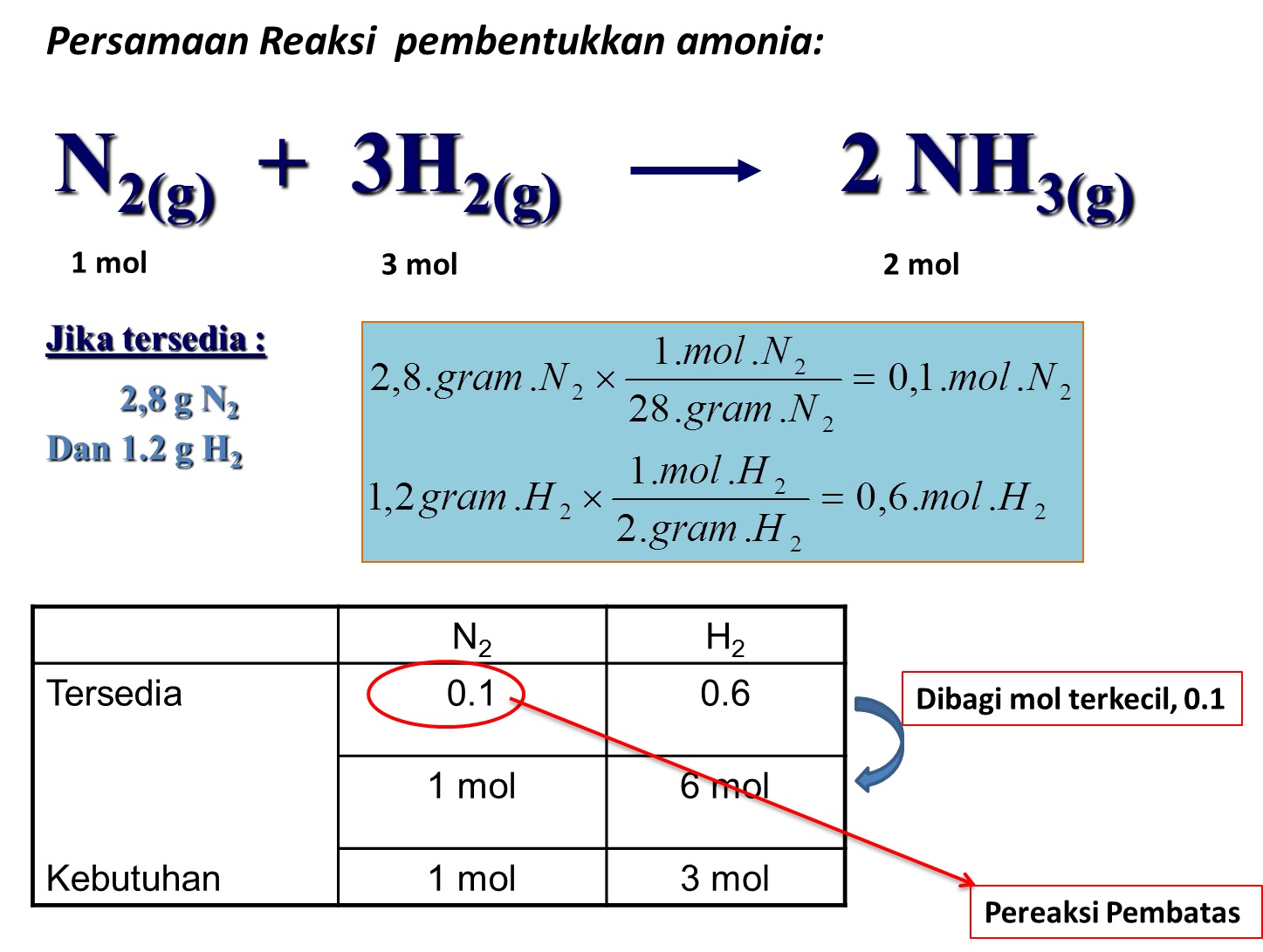
Rasio Mol: Definisi dan Contoh. Dalam reaksi kimia, senyawa bereaksi dalam rasio yang ditetapkan. Jika rasio tidak seimbang, akan ada sisa reaktan. Untuk memahami hal ini, Anda harus terbiasa dengan rasio molar atau. Satuan perbandingan mol adalah mol:mol atau bilangan tak berdimensi karena satuannya saling meniadakan.

Soal Mol Penjelasan Lengkap dan Komprehensif tentang Mol dalam Kimia
Fraksi mol adalah perbandingan antara jumlah zat suatu komponen (bisa pelarut maupun zat terlarut) dan jumlah zat total atau mol zat totalnya. Mol zat total meliputi mol pelarut dan mol zat terlarut. Di dalam Kimia, penentuan fraksi mol merupakan hal yang paling penting untuk dilakukan. Mengingat, semua sifat-sifat fisik dari suatu larutan.
Konsep Mol pada Perhitungan Kimia
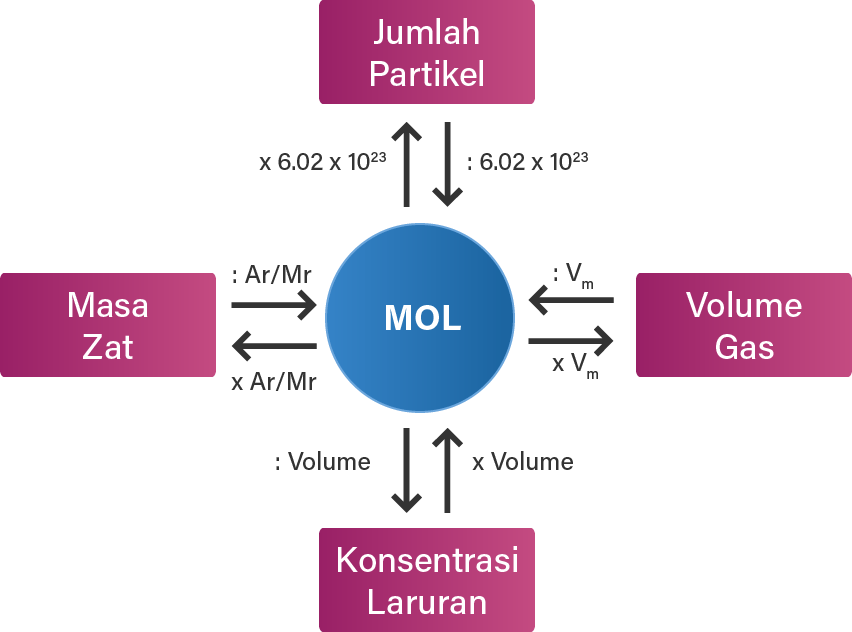
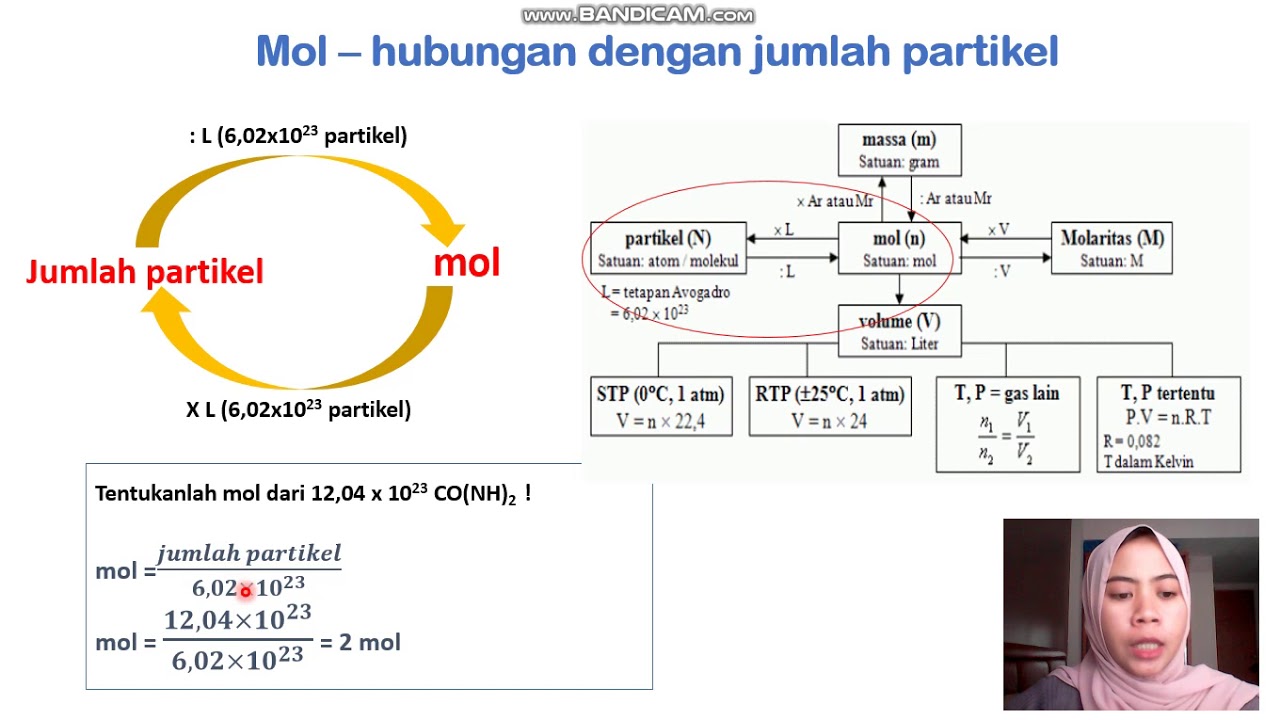
Kecilnya partikel dalam suatu reaksi kimia menyulitkan kita untuk mengukur seberapa banyak maka digunakanlah konsep mol.. Bilangan Avogadro menyatakan bahwa dalam satu mol zat, terdapat partikel sejumlah 6,02214076x10^23. Baca juga: Pengertian dan Contoh Soal Fraksi Mol. Contohnya adalah 1 mol air mengandung 6,02214076x10^23 partikel air.
KONSEP MOL KIMIA KELAS 10, ANAK IPA WAJIB NONTON! YouTube
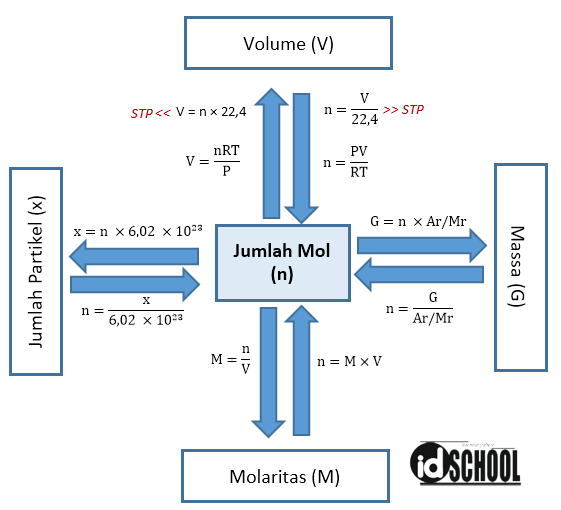
Mol adalah jumlah dari suatu zat yang mengandung jumlah satuan dasar (atom, molekul, dan ion) yang sama dengan atom-atom dalam 12 g isotop karbon (C-12). Mol merupakan satuan dasar SI untuk sejumlah zat. Pengertian mol dapat kita analogikan sebagai berikut. Apabila kita menghitung telur dengan satuan lusin (12 telur), dan kertas dengan satuan rim (500 lembar), maka ahli kimia menghitung jumlah.

MOL Ilmu Kimia
Mol (simbol: mol; bahasa Inggris dan Prancis: mole) adalah satuan pokok untuk besaran jumlah zat dalam Sistem Satuan Internasional (SI). Setelah redefinisi pada tahun 2019, definisi satuan mol, seperti yang disebutkan dalam Brosur SI edisi kesembilan, adalah sebagai berikut.. Mol, yang disimbolkan dengan mol, adalah satuan jumlah zat dalam SI. Satu mol mengandung persis 6,022140 76 × 10 23.

Konsep Mol Kimia Lengkap Pengertian, Penjelasan, Istilah, Latihan Soal dan Pembahasannya
Untuk berpindah dari molekul ke mol, bagi jumlah molekul dengan 6,02 x 10 23 . Misalnya, jika Anda tahu ada 3,35 x 10 22 molekul air dalam satu gram air dan ingin mencari berapa mol air ini: mol air = molekul air / bilangan Avogadro. mol air = 3,35 x 10 22 / 6,02 x 10 23. mol air = 0,556 x 10 -1 atau 0,056 mol dalam 1 gram air.

Konsep Mol dan Analisanya
Fraksi Mol dalam Kimia Fraksi mol adalah ukuran konsentrasi larutan yang menyatakan perbandingan jumlah mol sebagian zat terhadap jumlah mol total komponen larutan. Dalam kimia, fraksi mol didefinisikan sebagai jumlah konstituen dibagi dengan jumlah total semua konstituen dalam suatu campuran : Jumlah semua fraksi mol sama dengan 1: Fraksi mol juga disebut fraksi jumlah dan identik dengan.

Contoh soal kimia tentang fraksi mol 2021
Dalam melakukan perhitungan yang berhubungan dengan senyawa kimia atau reaksi, mol adalah konsep yang selalu digunakan. Segala perhitungan kimia ini dilakukan menggunakan prinsip-prinsip tertentu yang telah ditentukan agar tercipta reaksi yang lebih efisien, lho .

Kimia Tingkatan 4 KSSM Bab 3 Konsep Mol (Bahagian 1) Konsep Mol, Formula dan Persamaan Kimia
Ilmu kimia adalah ilmu yang berlandaskan eksperimen, dimulai dari pengamatan, kemudian diperoleh data yang selanjutnya didapatkan keteraturan. Keteraturan yang diperoleh secara eksperimen disebut hokum.. Jadi, dalam satu mol suatu zat terdapat 6,022 x 10²³ partikel. Nilai 6,022 x 10²³ partikel per mol disebut sebagai tetapan Avogadro.

Konsep Mol Pada Kimia Rezfoods Resep Masakan Indonesia
Dalam bidang kimia ada beberapa satuan yang sering digunakan untuk menyatakan konsentrasi larutan ( banyaknya zat terlarut dalam sejumlah pelarut ). Beberapa satuan konsentrasi itu antara lain : mol, molalitas, molaritas, normalitas, ppm, persen massa, persen volum. Berikut akan saya jelaskan pengertian dan rumus dari satuan-satuan di atas : 1.

Pengertian Mol Konsep dan Penggunaannya dalam Kimia
Dalam kimia. Massa molar, simbol M, adalah massa dari satu mol sebuah unsur atau senyawa kimia. Ia merupakan sifat fisik dari tiap-tiap senywa murni. Satuan SI untuk massa adalah kilogram, namun atas alasan praktis dan historis, massa molar hampir selalu dituliskan dalam satuan gram per mol (g/mol), utamanya dalam bidang kimia.
5 Tahapan Reaksi Kimia kabarmedia.github.io
Contoh Soal Konsep Mol Beserta Jawabannya. 1. Sebanyak 4,9 gram H2SO4 H 2 SO 4 dilarutkan dalam air sehingga diperoleh 500 mL larutan. Tentukan jumlah ion yang yang terlarut dalam larutan dan tentukan konsentrasi ion H+ H +. Jawaban contoh soal konsep mol dan penyelesaiannya. nH2SO4 = m Mr = 4, 9 98 = 0, 05 mol n H 2 SO 4 = m M r = 4, 9 98 = 0.

Konsep Mol Kimia Kelas 10 • Part 1 Hubungan Mol & Massa, Jumlah Partikel, Volume Gas, Molaritas
Pengertian Konsep Mol, 4 Rumus, dan Contoh Soalnya. Oleh Ilmu Kimia Diposting pada 8 Januari 2022. Konsep mol bisa dikataan sebagai ilmu dasar yang harus dikuasai dalam mempelajari penerapan kimia yang lebih dalam. Kita tidak dapat menghindarinya karena ilmu kimia modern telah mengeksplorasi aspek secara kualitatif dan kuantitatif.

Fraksi mol dan molalitas (m) Soal dan Pembahasan KIMIA KELAS 12 YouTube
Penggunaan Satuan Mol dalam Ilmu Kimia sangat banyak, seperti dalam perhitungan reaksi kimia, pembuatan obat-obatan, produksi industri, dan sebagainya. Oleh karena itu, pemahaman mengenai konsep mol dan satuan mol sangat penting dalam memahami ilmu kimia secara menyeluruh.. Contoh penggunaan rumus ini adalah dalam menghitung jumlah molekul.

Cara Mencari Rumus Molekul Unsur dan Senyawa Kimia Kelas 10 Belajar Gratis di Rumah Kapan
Apa Arti m dan M dalam Kimia? Baik m dan M adalah satuan konsentrasi larutan kimia. Huruf kecil m menunjukkan molalitas, yang dihitung menggunakan mol zat terlarut per kilogram pelarut. Suatu larutan yang menggunakan satuan-satuan ini disebut larutan molal (misalnya, 0,1 m NaOH adalah larutan 0,1 molal natrium hidroksida).