
Perbedaan Molaritas Dan Molalitas Riset
1. Tentukan jumlah partikel H2O dalam 2 gram. Kita tahu bahwa massa molekul H2O adalah sekitar 18 gram per mol. Oleh karena itu, 2 gram H2O setara dengan: 2 gram H2O x (1 mol H2O / 18 gram H2O) = 0,111 mol H2O. 2. Gunakan rumus mol = jumlah partikel / Avogadro's number. Mol = 0,111 mol H2O / (6,02 x 10^23 partikel/mol) = 6,96 x 10^-24 mol.

Soal Kimia Tentang Konsep Mol Satuan Jumlah Zat Read Master
1. Suatu larutan, memiliki fraksi mol zat terlarut sebesar 0,2. Jika ke dalam larutan tersebut ditambahkan lagi zat terlarut yang sama sebanyak 0,2 mol, fraksi mol zat terlarutnya menjadi 1 / 3. Maka banyaknya mol zat pelarut dalam larutan tersebut adalah…. a. 0,4 mol. b. 0,5 mol. c. 0,6 mol. d. 0,8 mol. e. 1,0 mol. Jawaban: Diketahui: X t.

SATUAN KONSENTRASI MOLALITAS DAN FRAKSI MOL YouTube
Mol merupakan salah satu konsep dalam kimia yang digunakan untuk mengukur jumlah zat. Kali ini akan mengenal pengertian, konsep, dan rumus mol yang ada dalam ilmu sains.. Sedangkan satu mol adalah satuan banyaknya partikel atau merupakan penyederhanaan jumlah partikel suatu ion, molekul, atau unsur. Adapun berikut adalah beberapa konsep mol.

Kimia Tingkatan 4 KSSM Bab 3 Konsep Mol (Bahagian 1) Konsep Mol, Formula dan Persamaan Kimia
Para ahli kimia yang bergabung dalam IUPAC (International Union Pure and Applied Chemistry) sepakat menggunakan satuan yang disebut mol. Satu mol adalah jumlah. Skip to the content.. Banyaknya atom yang terdapat dalam 12 gr C-12 adalah 6,02 x 10 23 partikel yang disebut dengan tetapan Avogadro dan dinyatak dengan huruf L. Dalam ketentuan.

Fraksi Mol Dan Molalitas M Soal Dan Pembahasan Kimia Kelas 12 Riset
Mol (simbol: mol; bahasa Inggris dan Prancis: mole) adalah satuan pokok untuk besaran jumlah zat dalam Sistem Satuan Internasional (SI). Setelah redefinisi pada tahun 2019, definisi satuan mol, seperti yang disebutkan dalam Brosur SI edisi kesembilan, adalah sebagai berikut.. Mol, yang disimbolkan dengan mol, adalah satuan jumlah zat dalam SI. Satu mol mengandung persis 6,022140 76 × 10 23.

Massa Jenis dan Cara Mengukurnya Fisika SMP
Mol adalah satuan dasar dalam kimia yang digunakan untuk mengukur jumlah partikel dalam suatu zat. Satu mol suatu zat mengandung jumlah partikel yang sama, yaitu 6,022 x 10^23 partikel. Mol digunakan dalam berbagai perhitungan dan konsep kimia, seperti konsentrasi, stoikiometri, dan reaksi kimia.

Satuan Untuk Mengukur Berat Yang Digunakan Dalam Sistem Internasional Adalah Homecare24
Secara sederhana, mol adalah satuan dari jumlah zat di dalam perhitungan kimia menggunakan konsep mol. Tentunya, tidak ada dong yang mau menghitung jumlah partikel yang sangat banyak? Untuk itu, mol digunakan agar lebih memudahkan perhitungan. Mol sendiri masih ada kaitannya dengan massa atom relatif dimana jumlah zat di sini akan bersifat.

Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40 (Mr NaOH = 40
Biasanya satuan molaritas ini ditandai dengan huruf M atau disebut juga Molar. Perlu diingat, bahwa huruf M yang dipakai adalah huruf M kapital. Nah, rumus konsentrasi larutan berdasarkan satuan molaritas adalah sebagai berikut. Keterangan: M = molaritas zat (molar) n = mol suatu zat (mol) V = volume larutan (liter)

Konsep Mol Kimia Kelas 10 • Part 1 Hubungan Mol & Massa, Jumlah Partikel, Volume Gas, Molaritas
Pengertian dan Rumus Satuan Mol. Pengertian dan Rumus Satuan Mol - Untuk memudahkan dalam mengukur dan mengetahui jumlah benda, kita memerlukan satuan, misalnya 1 lusin untuk 12 barang, 1 kodi untuk 20 barang, dan sebagainya. Namun untuk benda yang relatif kecil dan tidak bisa dihitung satu per satu, kita tidak lagi menggunakan satuan lusin.

Pengertian Mol Konsep dan Penggunaannya dalam Kimia
Untuk mempermudah perhitungannya maka digunakan satuan umum yang dapat menyatakan jumlah partikel dalam zat, yaitu mol. Namun, karena massa setiap zat dalam 1 mol itu nggak sama maka perlu ada penghubung nih antara kamu dan dia. Ups salah!. 1 mol menyatakan banyaknya partikel dalam suatu zat, yang mana jumlahnya sama dengan jumlah partikel.

Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40 (Mr NaOH = 40
Konsep Mol Mol adalah satuan dasar SI (Satuan Internasional) yang mengukur jumlah zat. Jika Anda telah mempelajari atom, molekul dan ion sebagai partikel-partikel materi. Bagaimana caranya menghitung jumlah yang sangat banyak dari partikel-partikel materi yang berukuran sangat kecil tersebut? Untuk menyederhanakan jumlah partikel yang sangat kecil ini digunakan istilah MOL.
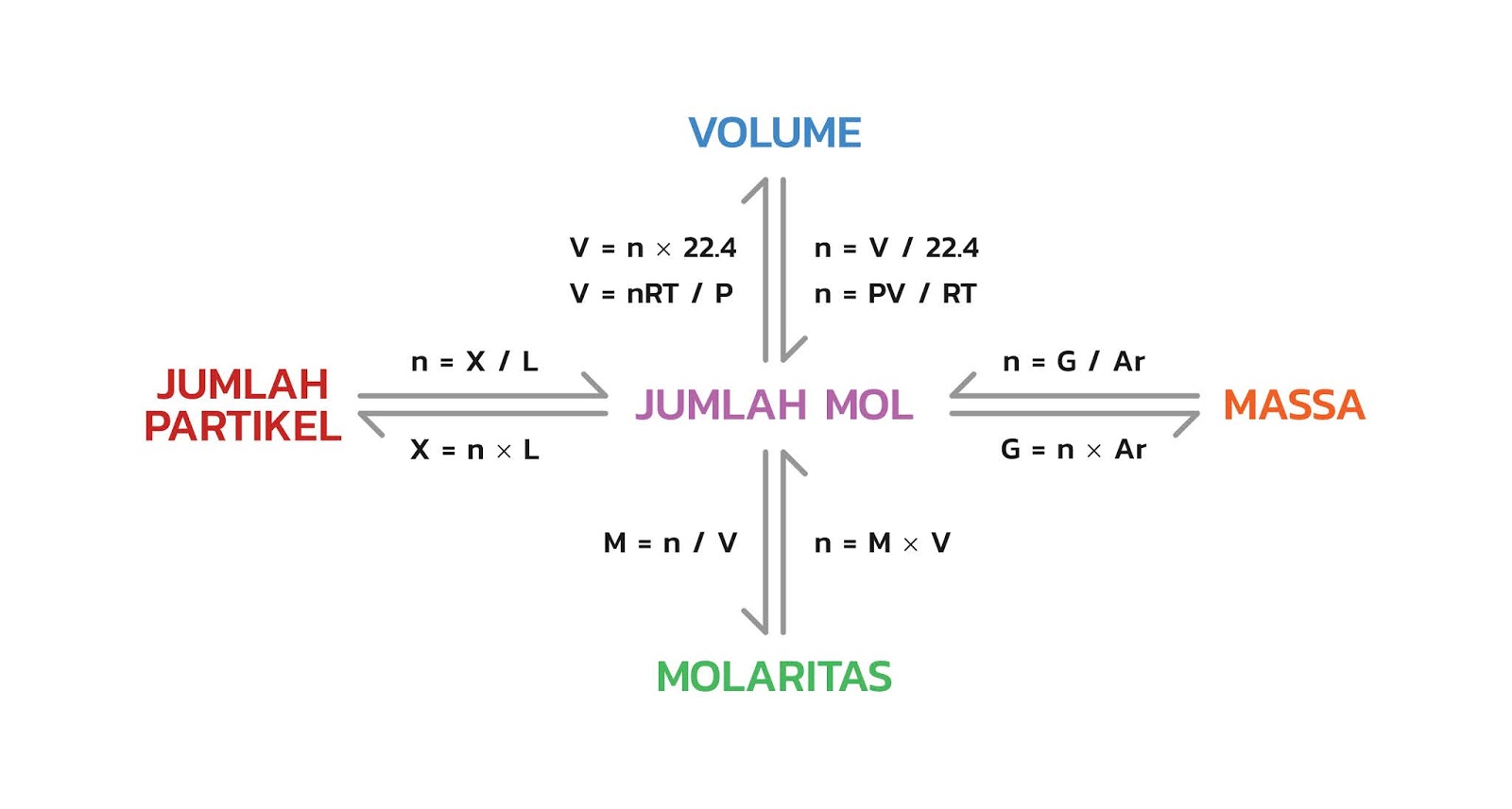
Hubungan Mol Dengan Jumlah Partikel Massa Volume Dan Molaritas Riset
Mol (simbol: mol; bahasa Inggris dan Prancis: mole) adalah satuan pokok untuk besaran jumlah zat dalam Sistem Satuan Internasional (SI). Setelah redefinisi pada tahun 2019, definisi satuan mol, seperti yang disebutkan dalam Brosur SI edisi kesembilan, adalah sebagai berikut. [1] Mol, yang disimbolkan dengan mol, adalah satuan jumlah zat dalam SI. Satu mol mengandung persis 6,022140 76 × 10 23.

Macam Macam Bentuk Tes Dan Pengukuran Untuk Mengukur Tingkat Kesegaran Reverasite
Sungguh besaran yang tidak dapat dijangkau dengan indera manusia. Bilangan tersebut lebih dikenal sebagai bilangan Avogadro. Untuk 1 mol zat mengandung 6,02 × 10 23 partikel. Dengan demikian, hubungan antara jumlah mol dan jumlah partikel dirumuskan sebagai berikut. Massa Molar. Massa molar adalah massa satu mol zat yang nilainya sama dengan.
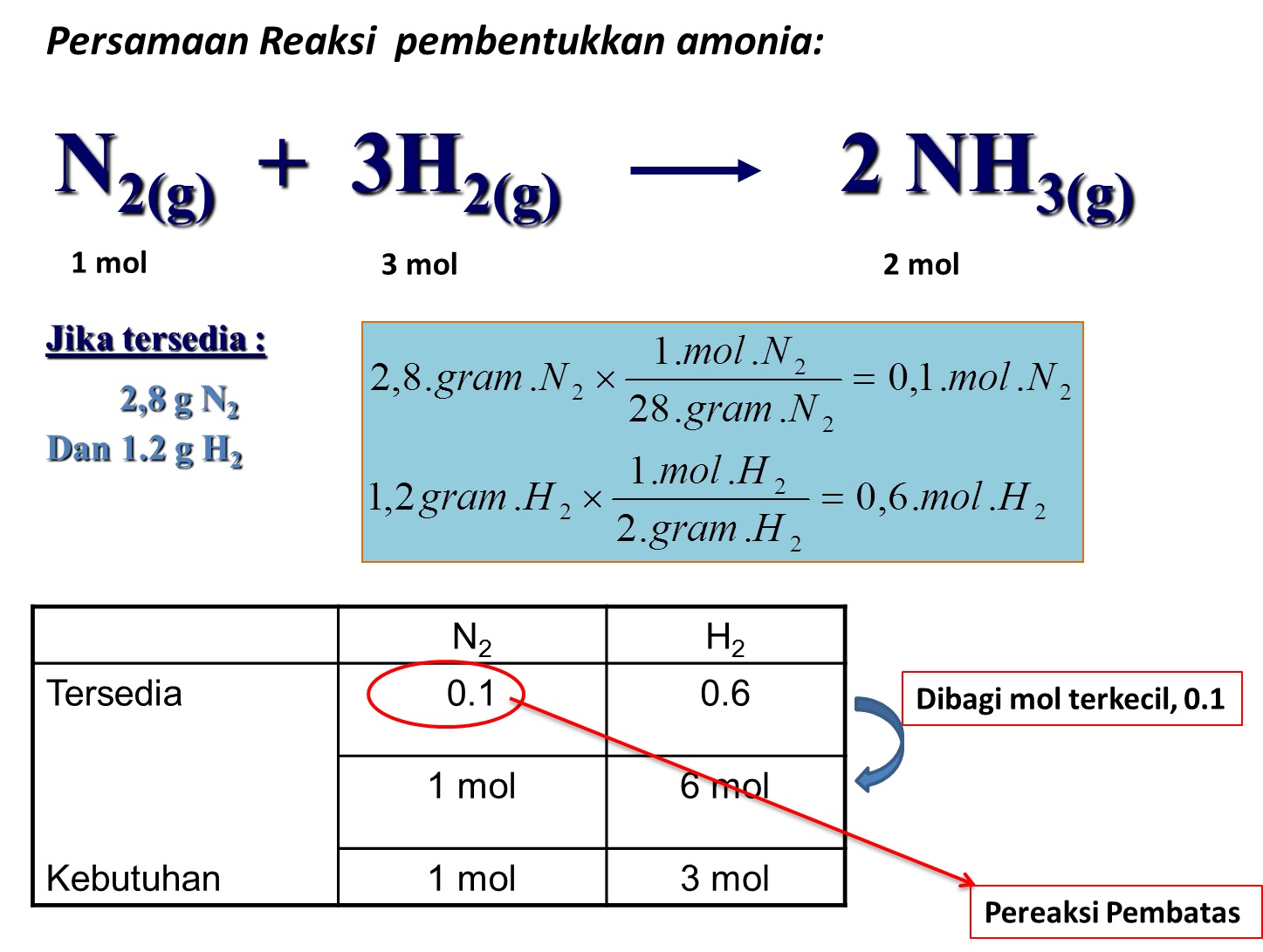
5 Tahapan Reaksi Kimia kabarmedia.github.io
Konsep mol adalah Ide atau pengertian mengenai mol, yakni satuan jumlah suatu zat. Jumlah mol dinyatakan dengan simbol n Banyaknya atom atau partikel yang terdapat dalam 12 gram C-12 adalah $6,02\times10^{23}$ partikel yang disebut dengan tetapan Avogadro yang dinyatakan dengan simbol L atau NA.

Soal Mol Penjelasan Lengkap dan Komprehensif tentang Mol dalam Kimia
Dalam bidang kimia ada beberapa satuan yang sering digunakan untuk menyatakan konsentrasi larutan ( banyaknya zat terlarut dalam sejumlah pelarut ). Beberapa satuan konsentrasi itu antara lain : mol, molalitas, molaritas, normalitas, ppm, persen massa, persen volum. Berikut akan saya jelaskan pengertian dan rumus dari satuan-satuan di atas : 1.
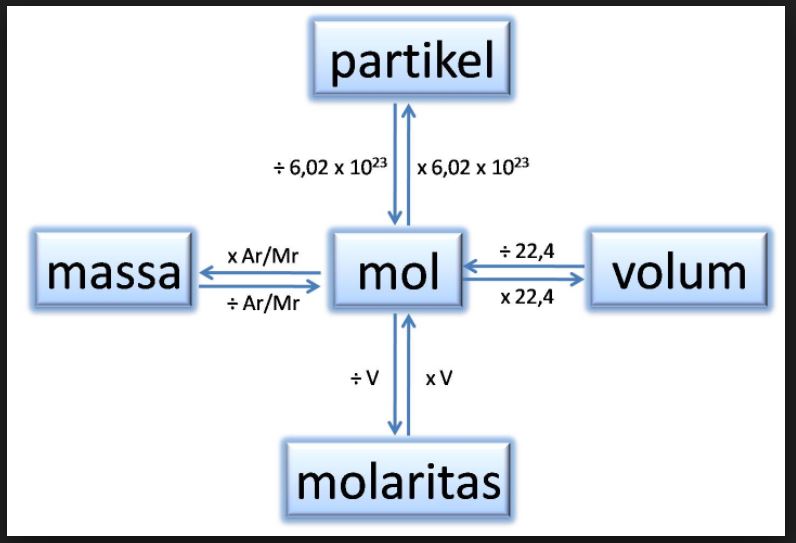
Hubungan Mol dengan Jumlah Partikel dan Massa Zat cekrisna
Ingat, rumus molaritas pencampuran adalah: Maka, konsentrasi larutan setelah dicampurkan adalah: M campuran = (100 x 0,1) + (150 x 0,2) / (100 + 150) = 40 / 250. = 0,16 M. Quipperian, itu dia pembahasan mengenai rumus molaritas beserta contoh soal dan pembahasannya. Agar semakin paham dan mahir dalam menggunakan rumus molaritas, cobalah untuk.