
How to Draw the Lewis Dot Structure for MnO4 Permanganate ion YouTube
2.3 Prinsip Titrasi Permanganometri Permanganometri adalah titrasi yang didasarkan pada reaksi redoks. Dalam reaksi ini, ion MnO4- bertindak sebagai oksidator. Ion MnO4- akan berubah menjadi ion Mn2+ dalam suasana asam. Teknik titrasi ini biasa digunakan untuk menentukan kadar oksalat atau besi dalam suatu sampel.
Setarakan Persamaan Reaksi Redoks Berikut Menggunakan Metode Perubahan Hot Sex Picture
1. This is the data given: M n O X 4 X − / M n X 2 + = 1.5 V. M n O X 2 / M n X 2 + = 1.23 V. I know that : M n O X 4 X − + 5 e X − + 8 H X + M n X 2 +. M n O X 2 + 4 H X + + 2 e X − M n X 2 +. After that here's what's done which I absolutely don't get. After using Δ G ∘ = − n F E ∘, won't we have to multiply these energy values.
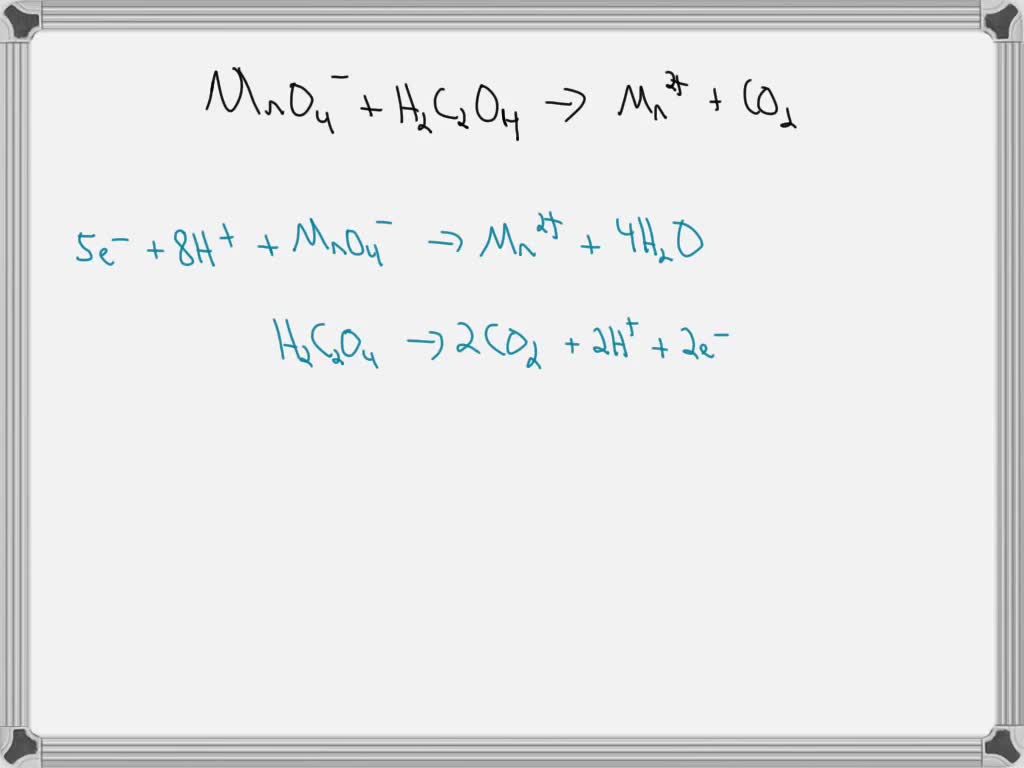
SOLVED The reaction of MnO4 with oxalic acid (H2C2O4) in acidic solution, yielding Mn2+ and
Explanation: Ferrous ion is oxidized: F e2+ → F e3+ +e− (i) And permanganate ion is reduced: M nO− 4 + 8H + +5e− → M n2+ +4H 2O(l) (ii) For each half-equation charge and mass are balanced ABSOLUTELY, and thus it reflects stoichiometry. TO produce a balanced equation, we adds (i) and (ii) in such a way as to remove the electrons as.
[MnO4] Permanganate
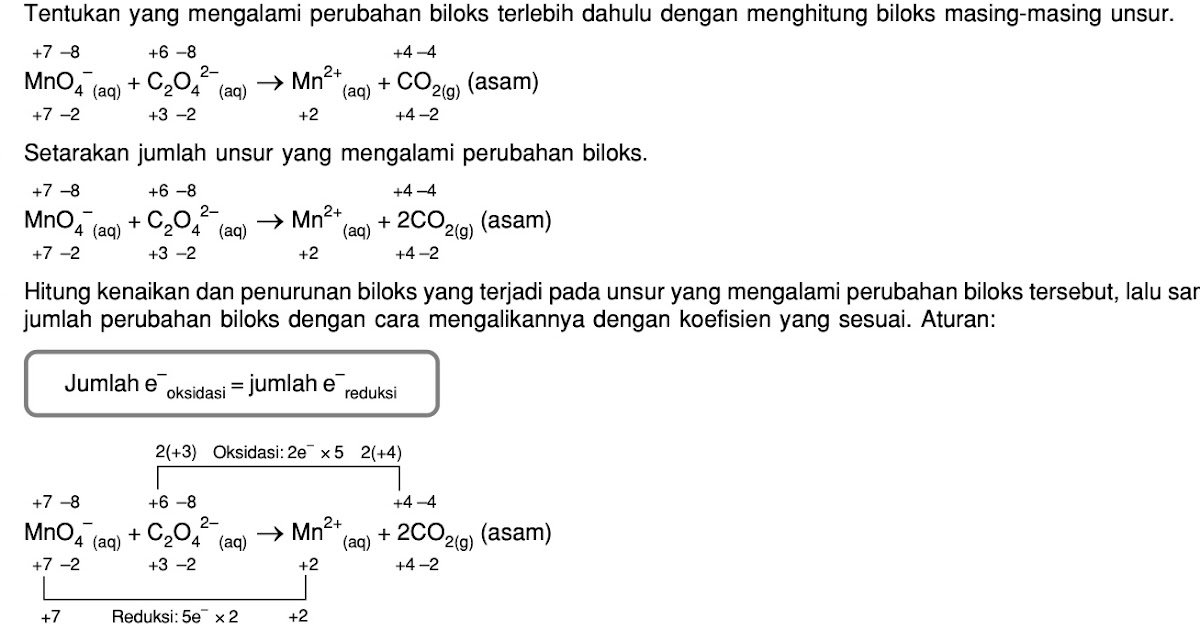
Q 1. Balance the equation : M nO4 −+C2O42− +H +→ CO2 +M n+2+H 2O. View Solution. Q 2. For the redox reaction. M nO− 4 +C2O−2 4 +H + M n2+ +CO2 +H 2O. the correct coefficients of the reactants M nO− 4, C2O2− 4 and H + for the balanced reaction are. View Solution.

PPT Redox PowerPoint Presentation, free download ID6880996
Step 4: Substitute Coefficients and Verify Result. Count the number of atoms of each element on each side of the equation and verify that all elements and electrons (if there are charges/ions) are balanced. Mn (OH)2 + 4 MnO4- + 6 OH- = 5 MnO42- + 4 H2O. Reactants.

Perhatikan reaksi redoks berikut! a MnO4^ + b H^+ + c H2...
Step 4: Substitute Coefficients and Verify Result. Count the number of atoms of each element on each side of the equation and verify that all elements and electrons (if there are charges/ions) are balanced. 2 MnO4- + 3 SO32- + H2O = 2 MnO2 + 3 SO42- + 2 OH-. Reactants.

Penyetaraan reaksi redoks metode bilangan oksidasi MnO4− + SO32− → MnO2 + SO42− dalam suasana
Solution. Steps to balance: Step 1: Separate the half-reactions that undergo oxidation and reduction. Oxidation: I− I2 I − I 2. This is the oxidation half because the oxidation state changes from -1 on the left side to 0 on the right side. This indicates a gain in electrons. Reduction: MnO−4 Mn2+ MnO 4 − Mn 2 +.

balance mno4 and br to give MnO2 and BrO3 YouTube
Balancing Redox Reactions: Basic Conditions . Problem: Balance the following reaction, and assume it takes place in basic solution: MnO4-+ S2-→ S + MnO2 In the example given, the two reactants are permanganate (MnO4-) with sulfide (S2-), and the products are sulfur (S) and manganese(IV) oxide (MnO2).It is

Balance the Redox Reaction for MnO4 + I → I2 + Mn 2+ YouTube
Penyetaraan reaksi redoks MnO4− + C2O42− → Mn2+ + CO2 menggunakan metode bilangan oksidasi (PBO) dalam suasana asamTonton juga video lainnya yaaa1. Penyetara.
Pada reaksi MnO4(aq) + C2O42(aq) → Mn2+(aq) + C...
Permanganat adalah sebuah nama umum untuk senyawa kimia yang mengandung ion manganat (VII) ion, (MnO 4− ). Karena mangan mempunyai bilangan oksidasi sebesar +7, maka ion permanganat (VII) merupakan oksidator kuat. Ion ini mempunyai bentuk geometri tetrahedral. [1] Larutan permanganat biasanya berwarna ungu dan bersifat neutral dan sedikit.

Berikut adalah reaksi redoks MnO4^ (aq) + CN^ (aq) >
MnO4- + C2O42- ---> MnO2 + CO2 ( suasana asam) ,setarakan dengan metode setengah reaksi!. (-4) = 0 b.o C = +4 Karena C mengalami perubahan biloks dari +3 menjadi +4 (biloks naik), maka reaksi yang dialami adalah oksidasi. Dalam metode setengah reaksi, langkah-langkah penyetaraan reaksinya yaitu : 1) Memisahkan setengah reaksi oksidasi dan.

MnO4+I=MnO2+IO3 balance the redox reaction by ion electron method in a basic medium. YouTube
Menentukan Biloks Mn pada Senyawa MnSO4, MnO2, MnO4-, MnO42-1. Reaksi Redoks - Konsep Reduksi Oksidasi: https://youtu.be/hE7a5K9v8Zg2. Aturan Penentuan Bilok.
.PNG)
Be Mno4 2 Estudiar
MnO4- adalah senyawa ion poliatomik, sehingga jumlah bilangan oksidasi atom penyusunnya = muatannya, muatan ion MnO4- = -1. Bilangan oksidasi adalah harga yang menunjukkan kemampuan suatu atom untuk melepaskan atau menerima elektron dalam suatu reaksi. 2. Aturan Penentuan Bilangan Oksidasi : a. Atom H dalam senyawa umumnya memiliki biloks = +1
STRUCTURE OF MNO4 YouTube
Meskipun besi (II) adalah agen pereduksi yang lebih kuat daripada ion klorida, ion yang belakangan disebut ini teroksidasi secara bersamaan dengan besi. Kesulitan semacam ini tidak ditemukan dalam oksidasi dari As 2 O 3 ataupun Na 2 C 2 O 4 dalam larutan asam klorida. Sebuah larutan dari mangan (II) sulfat, asam sulfat dan asam fosfat, disebut.

Metode IE/SR, Penyetaraan 18 MnO4 + Mn2+ → MnO2 (Konproporsionasi Basa) YouTube
In the oxidation number change method the underlying principle is that the gain in the oxidation number (number of electrons) in one reactant must be equal to the loss in the oxidation number of the other reactant. Step 1. Write down the unbalanced equation ('skeleton equation') of the chemical reaction. All reactants and products must be known.

MnO4 + C2O42 + H+ → CO2 + H2O + Mn2+ The correct coefficients in balanced equation are YouTube
Kalium permanganat adalah suatu senyawa kimia anorganik dan obat-obatan. Sebagai obat senyawa ini digunakan untuk membersihkan luka dan dermatitis.. Senyawa ini memiliki rumus kimia KMnO 4 dan merupakan garam yang mengandung ion K + dan MnO − 4.Senyawa ini merupakan agen pengoksidasi kuat. Ia larut dalam air menghasilkan larutan berwarna merah muda atau ungu yang intens, penguapan larutan.