Teori Asam dan Basa Menurut BronstedLowry
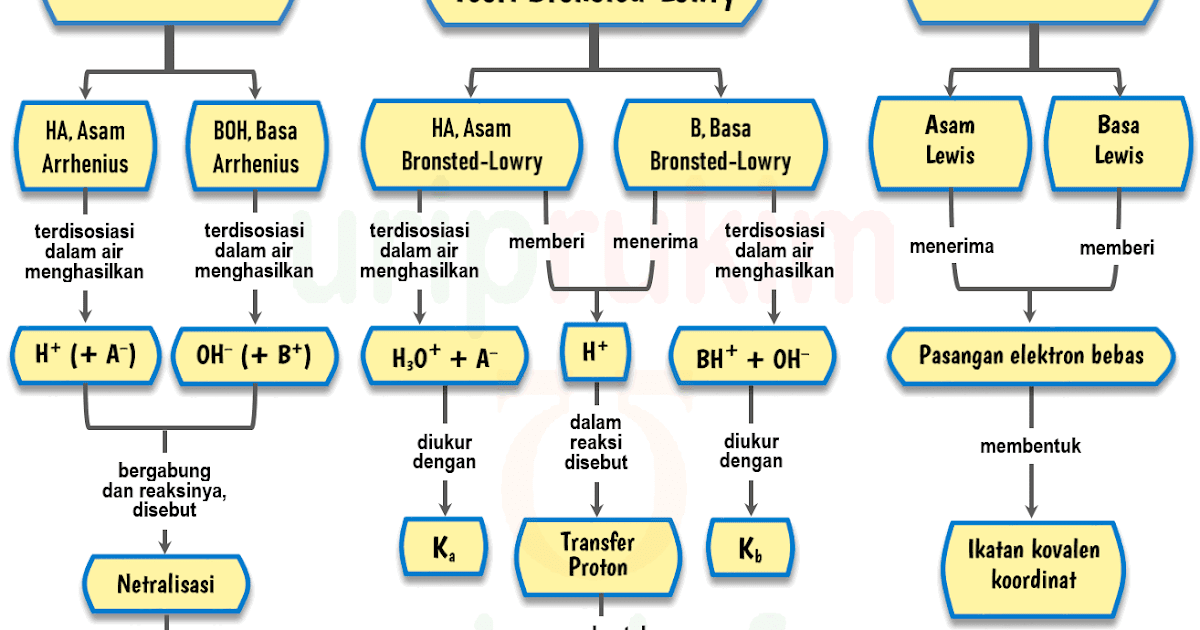
Tahun: 1886. Pada tahun 1886, seorang ilmuan berkebangsaan Swedia yang bernama Svante August Arrhenius mengemukakan teori mengenai asam dan basa. Teorinya tersebut diuraikan sebagai berikut. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hidronium (H3O+) atau ion hidrogen (H+) apabila dilarutkan dalam air.
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis
Zat asam dan basa dijelaskan dalam teori oleh beberapa pakar kimia, di antaranya teori Arrhenius, Bronsted-Lowry, dan Lewis. Asam-basa adalah sifat kimiawi yang dimiliki oleh bahan makanan, minuman, obat-obatan, dan zat lainnya. Disebutkan dalam laman Sumber Belajar Kemdikbud, bahwa secara umum asam mempunyai rasa masam dan basa mempunyai rasa.
Contoh Asam Basa Menurut Bronsted Lowry Berbagai Contoh
Teori asam basa menurut Bronsted Lowry didefinisikan berdasarkan kemampuan (donor) atau menerima (akseptor) proton (ion H +). Senyawa yang bertindak sebagai asam basa Bronsted Lowry disebut amfoter.. Asam menurut Lewis adalah zat yang punya kecenderungan menerima pasangan elektron basa, sedangkan basa adalah zat yang memberikan pasangan.
Unduh Skema Teori AsamBasa (Arrhenius, BronstedLowry, Lewis) Urip dot Info
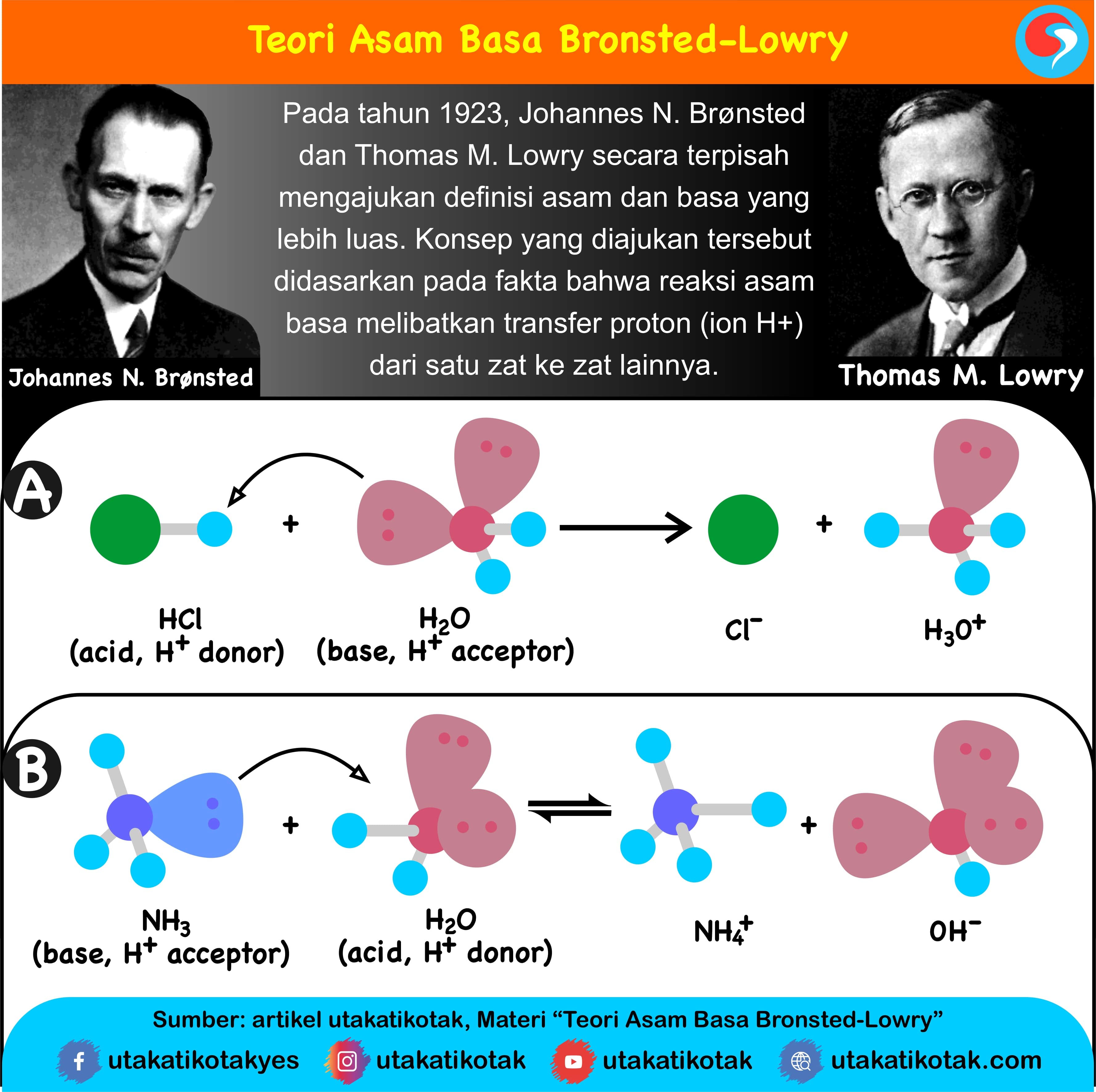
Teori Brønsted-Lowry adalah teori reaksi asam-basa yang diajukan secara terpisah oleh Johannes Nicolaus Brønsted dan Thomas Martin Lowry pada tahun 1923. Konsep dasar teori ini adalah bahwa ketika suatu asam dan basa bereaksi satu sama lain, asam akan membentuk basa konjugatnya, dan basa membentuk asam konjugatnya melalui pertukaran proton (kation hidrogen, atau H+).

Chocogreentea Keterbatasan Teori AsamBasa Bronsted Lowry
Setidaknya, ada tiga teori asam basa yang dikemukakan oleh para ahli, yaitu teori asam basa menurut Arrhenius, Bronsted-Lowry, dan Lewis. Berikut penjelasan lebih lanjutnya.. kekurangan dari teori asam basa yang dikemukakan oleh Bronsted Lowry adalah teori ini tidak mampu menjelaskan zat-zat yang tidak mengandung atom hidrogen, tapi bersifat.

Lihatlah Menurut Teori AsamBasa BronstedLowry Asam Didefinisikan Sebagai Zat Yang Sedang Trend
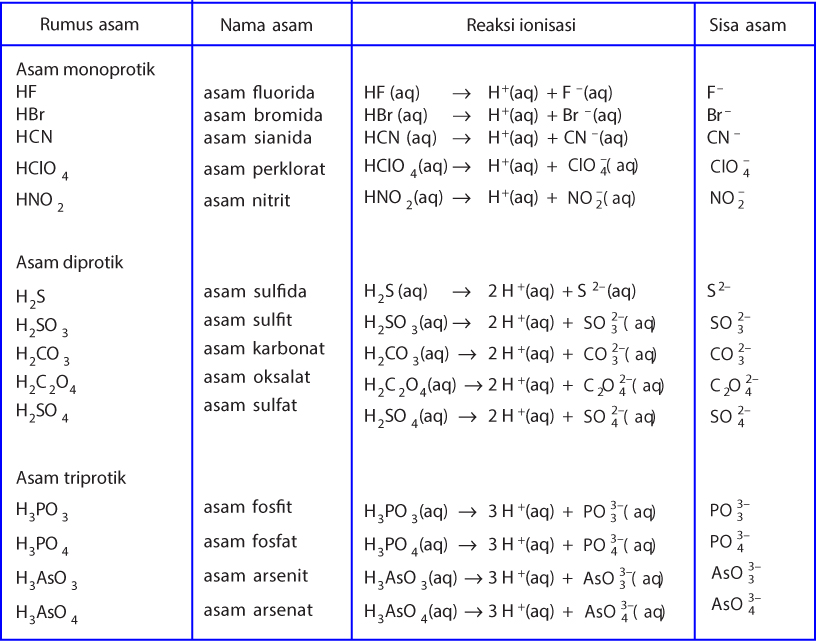
Terdapat beberapa karakteristik khas yang membedakan asam dan basa menurut teori Bronsted-Lowry: 1. Asam: - Asam dapat melepaskan ion H+. - Asam bersifat korosif dan dapat menyebabkan iritasi pada kulit. - Contoh asam umum meliputi asam klorida (HCl), asam sulfat (H2SO4), dan asam asetat (CH3COOH). 2.

Teori Asam Basa Arrheniuss, BronstedLowry,
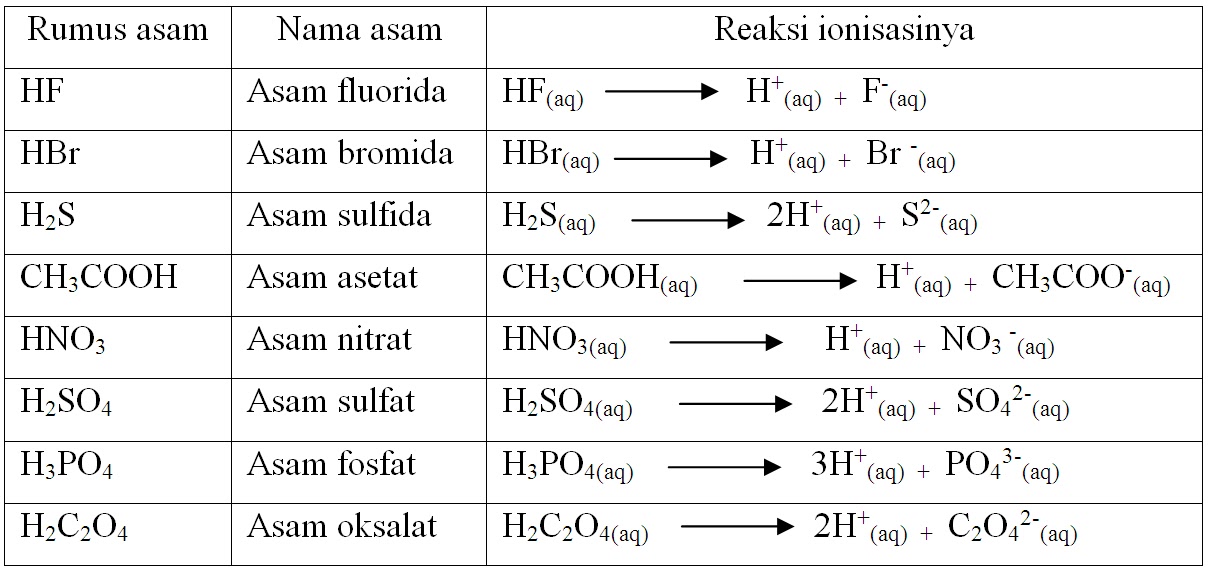
Contoh lain dari asam menurut Bronsted Lowry adalah senyawa seperti H2SO4 (asam sulfat) dan H3PO4 (asam fosfat) yang juga mampu melepaskan ion H+. Secara umum, asam menurut Bronsted Lowry dapat diidentifikasi dari kemampuannya untuk melepaskan proton ketika bereaksi dengan suatu basa. Misalnya, ketika asam asetat (CH3COOH) bereaksi dengan air.

Teori Asam Basa Bronsted Lowry YouTube
Asam menurut teori Bronsted-Lowry adalah zat kimia yang dapat menghasilkan ion hidrogen (H+) ketika larut dalam air. Teori ini dikemukakan oleh dua ilmuwan, yaitu Johannes Nicolaus Bronsted dan Thomas Martin Lowry pada tahun 1923. Daftar Isi. Asam Menurut Teori Bronsted-Lowry.

Menentukan Asam Basa Konjugat BronstedLowry YouTube
Konsep asam-basa Bronsted-Lowry tidak terbatas dalam pelarut air, tetapi juga menjelaskan reaksi asam-basa dalam pelarut lain atau bahkan reaksi tanpa pelarut.; Asam-basa Bronsted-Lowry tidak hanya berupa molekul, tetapi juga dapat berupa kation atau anion. Konsep asam-basa Bronsted-Lowry dapat menjelaskan sifat asam dari NH 4 Cl. Dalam NH 4 Cl, yang bersifat asam adalah ion NH 4 + karena.

Sintético 104+ Foto Acidos Y Bases De Bronsted Lowry Lleno
KOMPAS.com - Teori asam basa Bronsted dan Lowry adalah teori yang ditemukan pada tahun 1923 oleh Johannes Nicolaus Bronstes dari Denmark dan Martin Lowry dari Inggris. Keduanya mengemukakan pendapat mengenai asam basa secara terpisah. Teori asam basa yang mereka kemukakan menjelaskan tentang reaksi asam-basa sebagai proses transfer pasangan elektron.

Contoh Soal Asam Basa Bronsted Lowry Ruang Ilmu
Pengertian basa menurut teori asam basa bronsted-lowry adalah zat atau spesi (ion/molekul) yang menjadi penerima proton (akseptor H+ atau penerima hidrogen). Teori Bronsted-Lowry bisa digunakan saat menjelaskan sifat dari asam basa dengan menggunakan berbagai macam pelarut, tidak hanya air (H2O). Jadi bisa dituliskan bahwa:

Contoh Soal menentukan pasangan asam basa konjugasi menurut BronstedLowry YouTube
1. Memiliki persamaan dengan teori Bronsted dan Lowry, yaitu dapat menjelaskan sifat asam basa dalam pelarut lain maupun tidak punya pelarut. 2. Teori asam basa Lewis mampu menjelaskan sifat asam basa molekul atau ion yang punya pasangan elektron bebas atau yang dapat menerima pasangan elektron bebas, semisal pada pembentukan senyawa kompleks.
Menurut Konsep Asam Basa Bronsted Lowry mari semua dansa denganku lirik
Sedangkan basa menurut Arrhenius adalah zat yang dapat menghasilkan ion hidroksida (OH-) ketika ditaruh di dalam air.. Teori Asam Basa Menurut Bronsted-Lowry Bronsted-Lowry mendeskripsikan asam dan basa dengan jenis larutan yang bermacam-macam. Lengkapnya, asam adalah zat yang mampu memberikan ion H+ (donor proton), sedangkan basa menerima.

Contoh Asam Basa Menurut Bronsted Lowry Berbagai Contoh Riset
Teori asam basa Bronsted-Lowry menjadikan transfer proton (H+) untuk menentukan sifat asam atau basa suatu senyawa. Definisi asam menurut Bronsted-Lowry adalah zat yang dapat menyumbangkan (donor) proton, sedangkan basa adalah zat yang dapat menerima (penerima donor) proton. Dilansir dari Khan Academy, asam mengandung hidrogen yang dapat.

Perhatikan reaksi asambasa konjugasi menurut bronstedLo...
Definisi asam dan basa. Johannes Nicolaus Brønsted dan Thomas Martin Lowry, secara terpisah, memformulasi ide bahwa asam adalah donor proton (H +) sementara basa adalah akseptor proton. Menurut teori Arrhenius, asam didefinisikan sebagai senyawa yang jika terdisosiasi di dalam larutan akuatik membebaskan H+ (ion hidrogen).

Diketahui persamaan reaksi asam basa BronstedLowry berik...
Mereka adalah Svante Arrhenius, Bronsted-Lowry, dan Lewis. Berikut ini penjelasan mengenai teori-teori yang mereka kemukakan: 1. Asam Basa Menurut Arrhenius. Menurut Arrhenius, asam adalah zat yang menghasilkan ion hydronium (H+) saat dimasukkan ke dalam air. Sedangkan basa, menghasilkan zat lain yang berupa ion hidroksida (OH-).