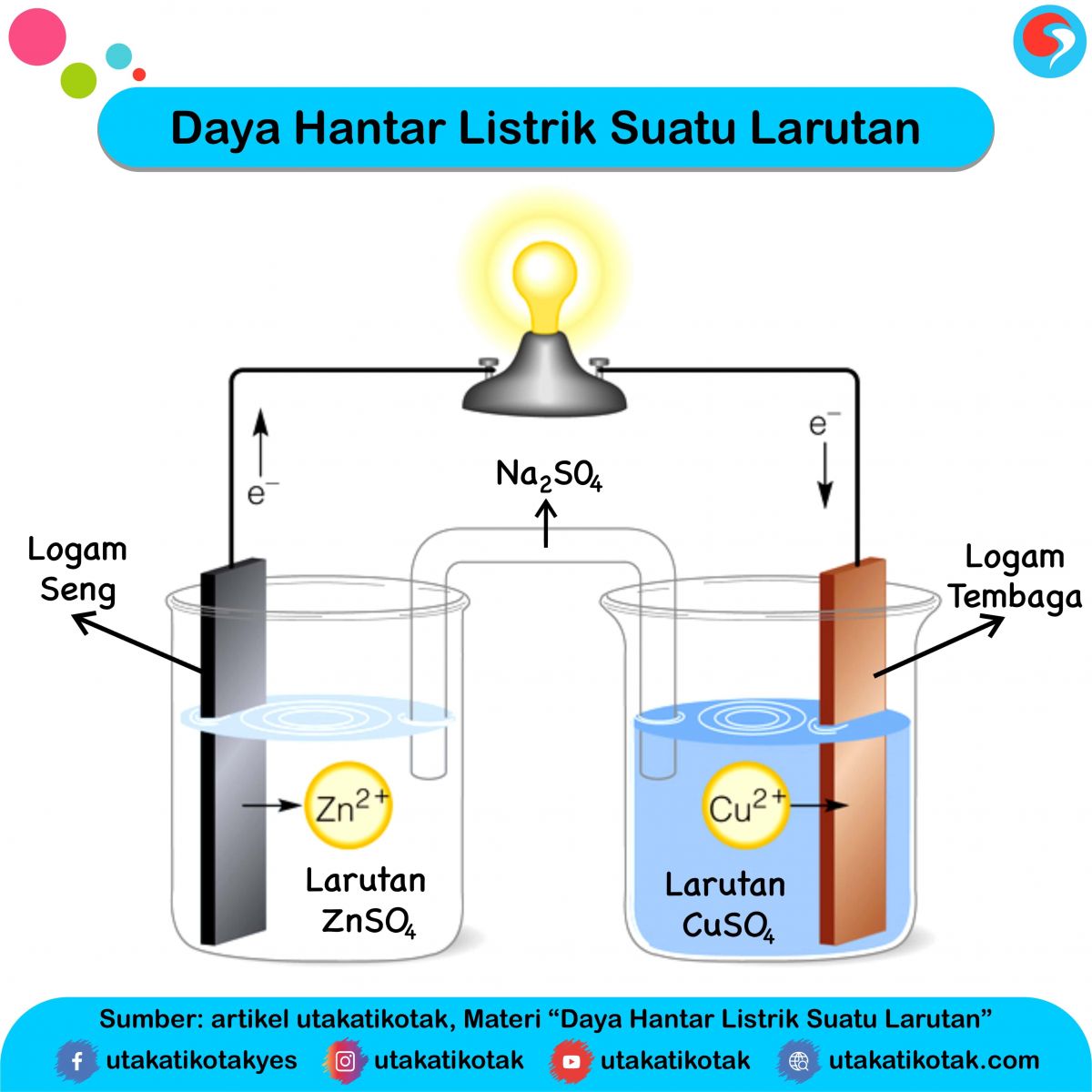
Daya Hantar Listrik Suatu Larutan
Larutan Nonelektrolit Selanjutnya, larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik, yang ditunjukan hasil percobaan (a), di mana lampu alat uji mati dan tidak dihasilkan gelembung gas dalam larutan. Larutan nonelektrolit ini tidak dapat menghantarkan listrik, sebab tidak terdapat ion-ion bebas dalam larutan, karena zat terlarutnya tidak terdisosiasi. Baca juga.
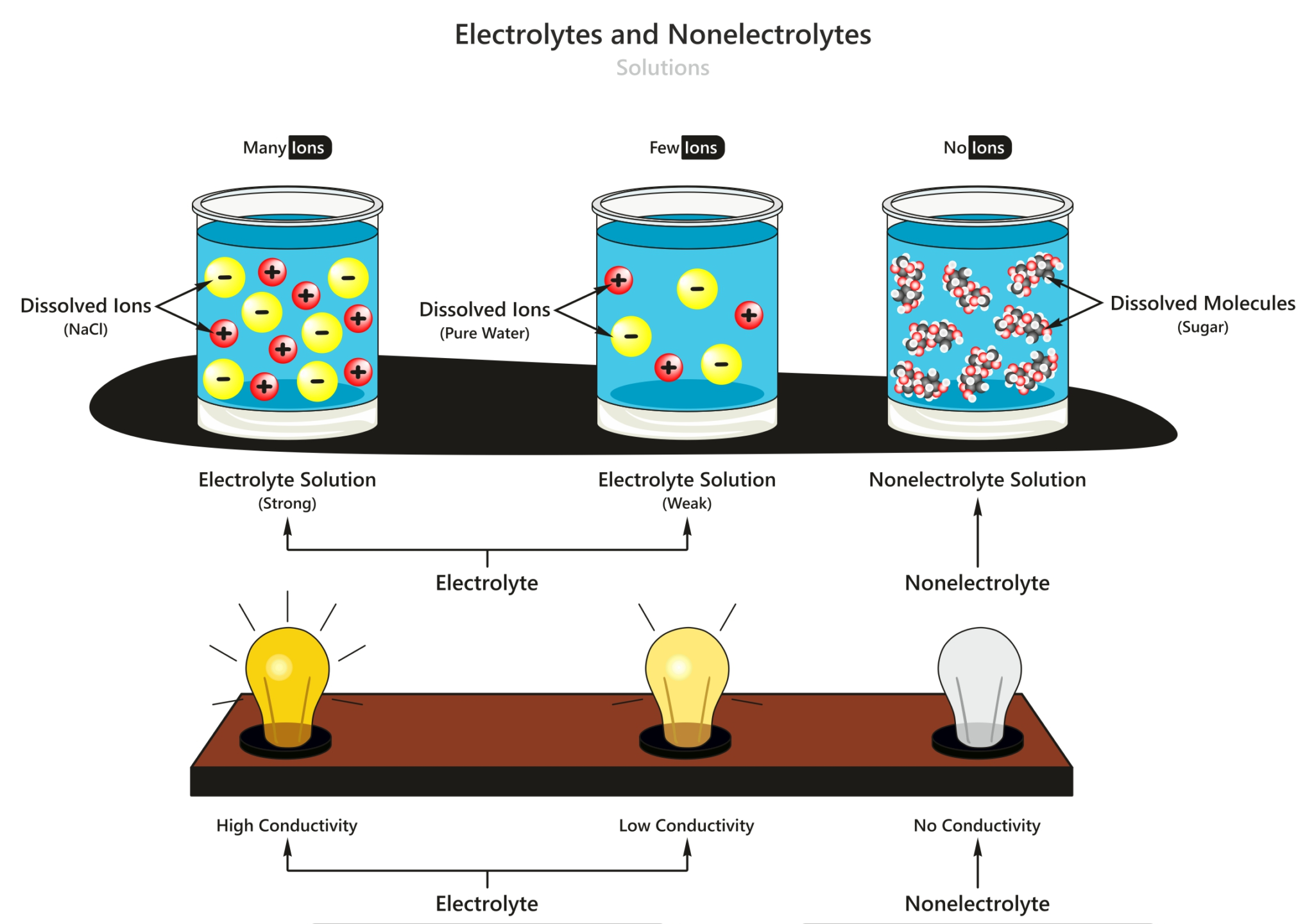
Larutan Elektrolit dan Non Elektrolit Materi Kimia Kelas 10
Larutan elektrolit merupakan larutan yang dapat menghantarkan listrik karena terionisasi menjadi ion-ion yang dapat bergerak bebas. Berdasarkan kekuatan daya hantar listriknya, larutan elektrolit dibedakan menjadi elektrolit kuat dan elektrolit lemah. Larutan elektrolit berasal dari senyawa ionik dan sebagian senyawa kovalen polar.

Kelompok zat berikut dapat menghantarkan arus listrik, ya...
Sedangkan larutan yang tidak dapat menghantarkan arus listrik disebabkan karena zat-zat tersebut tetap berwujud molekul-molekul netral yang tidak bermuatan. Berdasarkan daya hantarnya larutan elektrolit terbagi menjadi dua, yaitu elektrolit kuat dengan daya hantar yang besar. Contohnya larutan asam kuat, basa kuat dan garam. yang kedua.
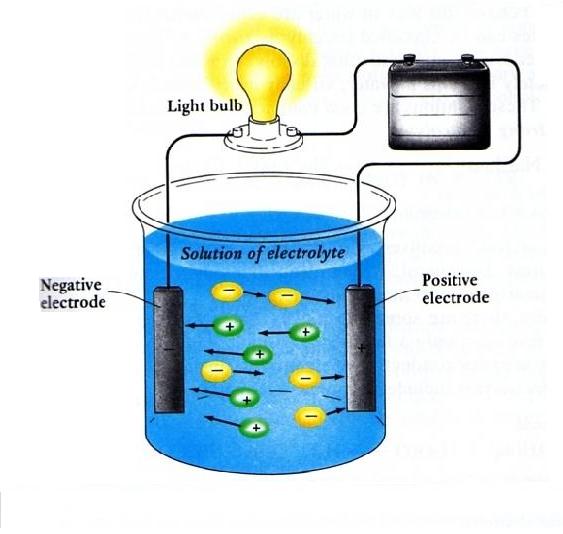
Life Is Beautiful Mengapa Larutan Elektrolit Dapat Menghantarkan Arus Listrik???
Larutan elektrolit dapat menghantarkan arus listrik karena zat elektrolit dalam larutannya terurai menjadi ion-ion bermuatan listrik dan ion-ion tersebut selalu bergerak bebas. . Larutan nonelektrolit tidak dapat menghantarkan arus listrik karena zat nonelektrolit dalam larutannya tidak terurai menjadi ion-ion, tetapi tetap dalam bentuk molekul.

Mengapa Larutan Elektrolit Dapat Menghantarkan Arus Listrik Neofotografi
Contoh elektrolit kuat adalah asam sulfat (air aki) dan natrium klorida (garam dapur). Larutan elektrolit lemah, merupakan elektrolit yang punya kekuatan daya hantar listrik lemah, hal ini disebabkan karena hanya sebagian kecil molekulnya saja yang terurai menjadi ion-ion. Nilai α pada larutan ini berada diantara 0 dan 1 (0 < α < 1).

Praktikum Uji Daya Hantar Listrik (Larutan Elektrolit dan Non Elektrolit) YouTube
1. Larutan elektrolit mengandung ion yang dapat bergerak, memungkinkan energi listrik untuk dikirimkan. 2. Larutan elektrolit berfungsi sebagai sumber daya dan konduktor untuk menghantarkan arus listrik. 3. Larutan elektrolit dapat digunakan untuk menghasilkan energi listrik, misalnya dalam baterai. 4.

Senyawa berikut yang dapat menghantarkan arus listrik ada...
Larutan elektrolit dapat menghantarkan arus listrik karena larutan elektrolit adalah larutan yang mengandung zat-zat yang dapat terionisasi atau terdisosiasi menjadi ion-ion positif dan negatif. Ion-ion ini dapat bergerak bebas dalam larutan dan membentuk arus listrik. Contoh larutan elektrolit adalah larutan garam, asam, basa, dan beberapa.

Suatu Larutan Dapat Menghantarkan Arus Listrik Apabila Mengandung YPHA.OR.ID
Larutan elektrolit adalah jenis larutan yang dapat menghantarkan arus listrik karena mengandung ion-ion yang bergerak bebas. Keberadaan ion-ion ini memungkinkan larutan elektrolit untuk melakukan konduksi listrik, baik dalam bentuk cairan maupun larutan padat.

30 Contoh Larutan Elektrolit dan Non Elektrolit
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Mengapa larutan elektrol.

√ Mengapa Larutan Elektrolit Dapat Menghantarkan Arus Listrik PPPA
Larutan elektrolit kuat dapat menghantarkan arus listrik dengan baik sehingga dapat menyalakan lampu dengan terang dan menimbulkan banyak gelembung gas. Elektrolit kuat dalam air akan terionisasi sempurna dengan derajat ionisasi (α) = 1. α = Jumlah mol zat yang terionisasi / Jumlah mol zat mula-mula. Kelompok larutan elektrolit kuat terdiri.

Larutan Elektrolit dan Non Elektrolit (Komponen Larutan)
Inilah alasan mengapa larutan elektrolit disebut sebagai larutan yang dapat menghantarkan arus listrik. Sedangkan larutan non elektrolit adalah senyawa yang tidak terionisasi sama sekali dalam larutan, tidak terdapat ion-ion di dalam larutan, zat hanya berupa molekul yang tidak bermuatan listrik. Tidak adanya aliran muatan dari pergerakan ion.

Larutan Elektrolit Dapat Menghantarkan Arus Listrik Karena?
Sehingga, ion dapat bergerak bebas di dalam larutan elektrolit. Ion-ion yang bergerak bebas itulah yang menjadi kunci mengapa larutan elektrolit dapat menghantarkan listrik. Ketika larutan elektrolit di aliri listrik, muatan listrik akan di bawa oleh ion. Ion-ion akan bergerak bebas sembari membawa muatan listrik, mengakibatkan arus listrik.

Cara larutan elektrolit menghantarkan arus listrik 2021
Pembahasan. Larutan elektrolit dapat menghantarkan listrik karena dapat terionisasi membentuk ion-ionnya, sehingga terjadi aliran elektron, sedangkan larutan nonelektrolit tidak dapat terionisasi. Berdasarkan daya hantar listrik, larutan dibagi menjadi larutan elektrolit dan larutan nonelektrolit. Larutan elektrolit adalah larutan yang dapat.

Larutan elektrolit it dan ict [PDF Document]
Dalam larutan, zat not-elektrolit tetap seperti molekul yang tidak bermuatan listrik. Itulah mengapa larutan ini tidak dapat menghantarkan arus listrik. Ciri-Ciri Larutan Non Elektrolit. Tidak dapat terionisasi; Tidak dapat menghantarkan arus listrik atau isolator; Tetapan atau derajat ionisasi (a) a = 0

Cara Larutan Elektrolit Menghantarkan Arus Listrik
Mengapa larutan elektrolit dapat menghantarkan listrik sedangkan larutan non elektrolit tidak? Larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion yang bergerak bebas. Ion-ion tersebut berperan menghantarkan arus listrik melalui larutan. Pada larutan elektrolit yang dilengkapi dengan elektroda dan rangkaian listrik, ion-ion negatif bergerak menuju elektroda yang bermuatan.
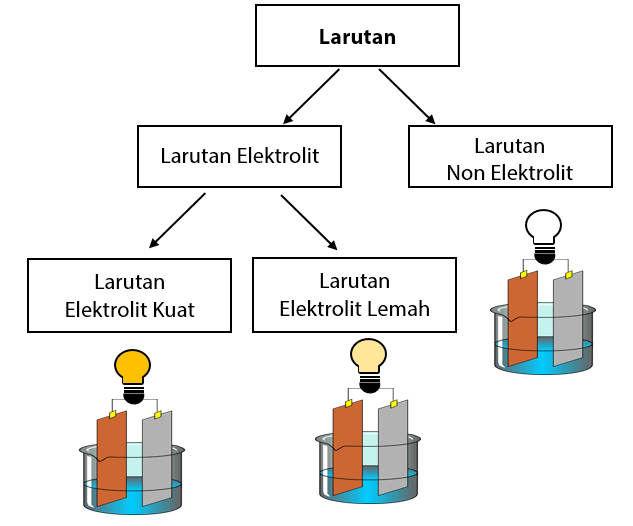
Larutan Elektrolit dan Non Elektrolit
Dengan demikian, larutan elektrolit dapat menjadi media yang penting dalam menghantarkan arus listrik. 1. Larutan elektrolit adalah bahan yang dapat melepaskan ion ke dalam larutan. 2. Ion-ion yang bebas bergerak di dalam larutan dapat mengikat dan melepaskan muatan listrik, sehingga dapat menghantarkan arus listrik. 3.