
Contoh Soal Titik Didih Larutan Sifat Koligatif Larutan Elektrolit
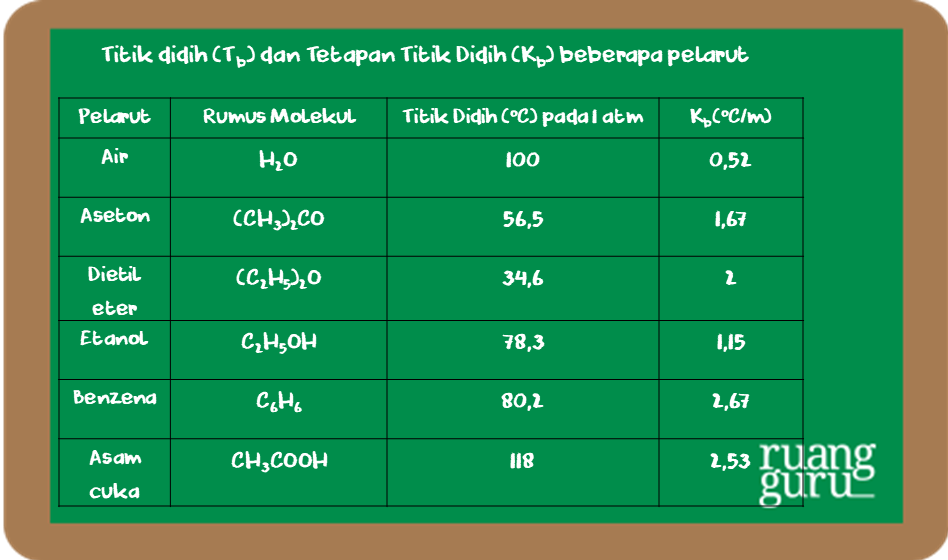
Contoh Soal dan Pembahasan. Berikut contoh soal dan pembahasannya mengenai kenaikan titik didih: Contoh Satu. Hitunglah titik didih larutan yang mengandung 18 g glukosa, C6H12O6. (Ar C = 12 g/mol, Ar H = 1g/mol, dan Ar O = 16 g/mol) dalam 250 g air. (Kb air = 0,52 °C/m) Jawab: ΔTb = Kbm. = 0,52 °C/m × 0,4 m. = 0,208 °C.

KIMIA KELAS XII SIFAT KOLIGATIF LARUTAN "KENAIKAN TITIK DIDIH LARUTAN" YouTube
Konsentrasi molal. Jenis zat terlarut. Jenis partikel zat terlarut. Jenis pelarut. Jumlah partikel zat terlarut. Latihan Soal Kenaikan Titik Didih & Penurunan Titik Beku (Sedang) Pertanyaan ke 1 dari 5. 9 gram glukosa C6H12O6. dilarutkan ke dalam 400 mL air sehingga terbentuk larutan NaOH.

Materi Kenaikan Titik Didih Dan Penurunan Titik Beku PDF PDF
Rumus Kenaikan Titik Didih. Adapun rumus kenaikan titik didih larutan adalah sebagai berikut. ΔT b = T b ° - T b. Keterangan : ΔT b = kenaikan titik didih larutan. T b ° = titik didih pelarut murni (air) T b = titik didih larutan. Kenaikan titik didih hanya tergantung pada jenis pelarut dan molaritas larutan, tidak tergantung pada jenis.

kenaikan titik didih(penjelasan di deskripsi) YouTube
30.4K subscribers. 647. 35K views 2 years ago KIMIA KELAS 12. Video ini berisi penjelasan materi tentang salah satu sifat koligatif larutan, yaitu kenaikan titik didih. Untuk mempermudah.

Kenaikan titik didih larutan yang terbentuk dari 18,2 g D...
Perubahan dari titik didih air menjadi titik didih campuran inilah yang disebut dengan kenaikan titik didih. Kenaikan titik didih memiliki rumus sebagai berikut : ΔTb : Tb Larutan-Tb Pelarut. Dengan keterangan : Tb larutan = titik didih larutan. Tb pelarut murni = titik didih pelarut (misal air : 100° C) ∆Tb = kenaikan titik didih

Contoh Kenaikan Titik Didih 50+ Koleksi Gambar
Kenaikan titik didih larutan adalah peristiwa di mana titik didih suatu larutan akan lebih tinggi daripada pelarut murninya. Misalnya, air memiliki titik didih 100 derajat celcius. Saat suatu zat dilarutkan, air akan berubah menjadi larutan dan titik didihnya menjadi lebih tinggi.

KENAIKAN TITIK DIDIH Ilmu Kimia
Konsep Kimia. Sifat Koligatif Larutan : Kenaikan Titik Didih. Pelajaran Kimia 6,115 views. Sifat Koligatif Larutan : Kenaikan Titik Didih. Kenaikan titik didih terjadi ketika titik didih larutan menjadi lebih tinggi dari titik didih pelarut murni. Suhu saat pelarut mendidih meningkat dengan menambahkan zat terlarut non-volatil.

Cara Mudah Menentukan Urutan Kenaikan Titik Didih ( Sifat Koligatif Larutan ) KIMIA SMA YouTube
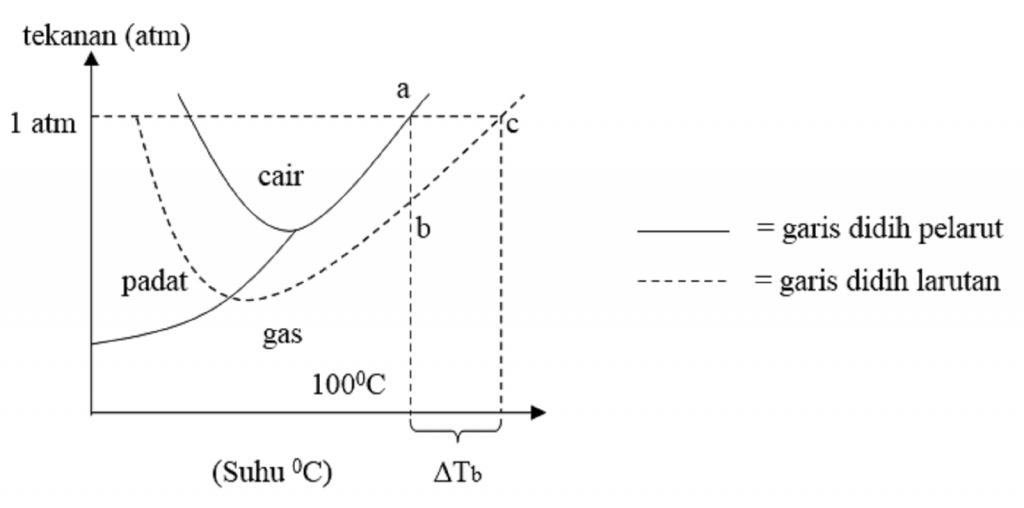
Pengertian Titik Didih. Titik didih adalah suhu dimana tekanan uap dari zat cair sama dengan tekanan di sekitarnya dan zat cair berubah menjadi suatu uap. Titik didih cairan tergantung pada tekanan lingkungan sekitarnya. Cairan dalam ruang vakum parsial memiliki titik lebih rendah daripada ketika cairan yang pada tekanan atmosfer.
Materi Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Pengertian titik didih. 02:50. Titik didih air. 02:57. Simbol titik didih pelarut murni. 03:07. Titik didih berbagai macam pelarut murni. 03:34. Ekstra materi tentang titik didih air di pegunungan. 04:21. Pengaruh penambahan zat terlarut terhadap titik didih pelarut.

Tetapan kenaikan titik didih molal (Kb) tergantung pada.
Hubungan antara kenaikan titik didih dengan konsentrasi (molalitas) larutan dapat dinyatakan dengan rumus : Rumus. Δ+Tb = Kb . m. Untuk larutan yang bersifat elektrolit, maka persamaannya akan berubah menjadi seperti berikut ini : Tb = Kb . m [ 1 + ( n - 1 ) a] Keterangan. Δ+Tb : Kenaikan titik didih (Tb larutan - Tb pelarut)

Kenaikan Titik Didih Dan Contoh Reverasite
Kenaikan Titik didih ( T b) merupakan suhu yang terbentuk ketika besar tekanan uap sebuah zat cair sama dengan besar tekanan eksternal yang dialami oleh cairan tersebut, atau mudahnya titik didih ini juga dapat disebut sebagai kondisi ketika sebuah zat pelarut atau sebuah larutan berada pada kondisi mendidih yang menyebabkan terjadinya.

Rumus Dan Contoh Soal Sifat Koligatif Kenaikan Titik Didih Dan Penurunan Titik Beku Materi
4.4K. 183K views 3 years ago MALANG. Materi ini bertujuan untuk memahami proses kenaikan titik didih suatu larutan dan bagaimana cara menghitung titik didih larutan tersebut. Dengan.

Materi Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
1 X. Kamu lagi nonton preview, nih. Masuk untuk lanjut belajar nggak pake hambatan. Pengertian Titik Didih. Apa sih itu mendidih? Kalo titik didih apa ya? Setelah nonton video ini, lo akan bisa menjelasakan persitiwa mendidih dan mendefinisikan titik didih. Yuk simak videonya! Deskripsi Materi. Detail Materi. Apa sih itu mendidih?

SIFAT KOLIGATIF LARUTAN KENAIKAN TITIK DIDIH YouTube
Mendidih. Related: Larutan elektrolit, non elektrolit, derajat ionisasi, dan faktor van't hoff. Mendidih adalah proses perubahan fase dari zat cair menjadi uap yang terjadi pada suhu tertentu yang disebut titik didih. Titik didih adalah suhu di mana tekanan uap zat cair sama dengan tekanan atmosfer sekitarnya.
Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
Titik didih adalah suhu pada saat tekanan uap larutan sama dengan tekanan luar yang. mengelilingi cairan tersebut. Oleh karena itu, titik didih cairan bergantung pada tekanan. atmosfer. Titik didih menjadi lebih rendah ketika tekanan atmosfer berkurang. cairan normal adalah suhu pada saat tekanan uapnya sama dengan 1 atm (760 torr).

10 Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Materi
Keterangan. ΔT f = kenaikan titik didih larutan T f = titik beku larutan T fo = titik beku pelarut murni m = molalitas K f = tetapan penurunan titik beku molal ( o C kg mol -1) Contoh Soal.