
PENENTUAN TITIK EKIVALEN DAN Ka ASAM LEMAH DENGAN METODE TITRASI KONDUKTOMETRI KELOMPOK 3 YouTube
Penentuan berat ekivalen suatu unsur Belajar dengan flashcard, permainan, dan masih banyak lagi — gratis.. Berat Ekivalen adalah.. Massa suatu unsur (senyawa) setara 1 mol elektron (1 gram hidrogen atau 8 gram oksigen)
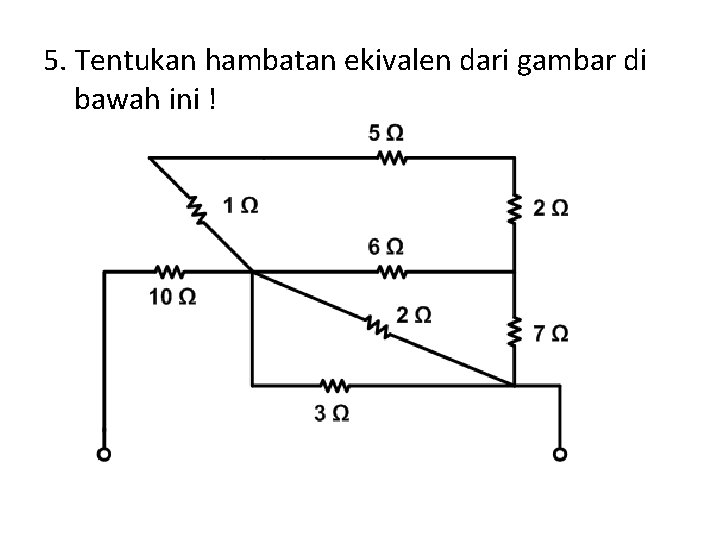
BAB V HAMBATAN EKIVALEN RANGKAIAN SEDERHANA Hubungan Seri
2. Rumus Hukum Faraday 2. Bunyi hukum Faraday II: "Massa zat yang dilepaskan pada elektrolisis berbanding lurus dengan massa ekuivalen zat itu". Berdasarkan bunyi hukum Faraday 2 tersebut, maka rumusnya adalah: Keterangan: ME = massa ekivalen. x = jumlah elektron yang diterima atau dilepaskan. Jika rumus hukum Faraday 1 dan 2 ini.

Saluran Transmisi Konstanta Propagasi Impedansi Karakteristik Rangkaian Ekivalen
Rumus dari berat ekuivalen adalah sebagai berikut. BE = Mr/n, dimana BE = berat ekuivalen (grek) Mr = Massa molekul relatif n = ekuivalen zat Penentuan ekivalen (n) suatu zat berbeda untuk tiap jenis reaksi. 1. Pada reaksi pengendapan, nilai ekuivalennya adalah muatan kation atau anion yang terlibat dalam reaksi. 2.

BAB V HAMBATAN EKIVALEN RANGKAIAN SEDERHANA Hubungan Seri
akbardwi - 17 September 2021 Hukum Faraday: Penerapan Dan Contoh Soal - Hukum Faraday menjelaskan tentang hubungan proses kimia dengan energi listrik. Proses ini sudah banyak dikenal diberbagai industri sebagai proses elektrolisis, yaitu proses perpindahan muatan listrik pada suatu larutan yang menghasilkan proses kimia pada larutan tersebut.

Mekanika Fluida II, Pipa Seri dan Ekivalen YouTube
Gram ekivalen (grek) =. g. E. Perhatikan contoh reaksi pembentukan air: 2 H2O + O2 → 2 H2O. Di sini 2 mol hidrogen direaksikan dengan 1 mol oksigen membentuk 2 mol mol air. Dalam hal massa, 4 gram hidrogen bereaksi dengan 32 gram oksigen membentuk 36 gram air. Proporsi yang relevan terlibat dengan persamaan ini adalah: Koefisien dari.

Artikel Ini Akan Membahas Perbedaan Rumus Molaritas Dan Molalitas Dan My XXX Hot Girl
Secara sistematis, Hukum Faraday I dapat disimpulkan dengan persamaan berikut: w ≈ Q. Keterangan : w = massa zat (kg) Q = muatan listrik dalam elektron (C) Baca : Sifat Koligatif Larutan Elektrolit, Soal, dan Pembahasannya. Jumlah muatan listrik yang dipakai (Q) sama dengan hasil kali antara kuat arus listrik (i) dan selang waktu (t).

PPT Dasar Dosimetri Pasien Radiologi Diagnostik PowerPoint Presentation ID4382852
Jika massa dalam kimia adalah gram, maka massa gram ekivalen dinyatakan oleh: Gram ekivalen (grek) = g E Perhatikan contoh reaksi pembentukan air: 2 H2O + O2 → 2 H2O Di sini 2 mol hidrogen direaksikan dengan 1 mol oksigen membentuk 2 mol mol air. Dalam hal massa, 4 gram hidrogen bereaksi dengan 32 gram oksigen membentuk 36 gram air.
Rumus Ekivalen Logika Matematika Riset
Massa ekivalen zat adalah massa atom relatif (Ar) dibagi dengan perubahan bilangan oksidasinya atau muatan ionnya. ME = Ar/biloks atau muatan ion Oke kalian sudah paham ya tentang Hukum Faraday 1 dan hukum faraday 2, selanjutnya kita akan lihat beberapa contoh soal hukum faraday nih, Squad. Contoh Soal Hukum Faraday Tembaga (Cu) mempunyai Ar =63,5.

menghitung hambatan ekivalen dari titik A dan B serta titik A dan C YouTube
Bagi massa molar zat dengan massa atom hidrogen untuk mendapatkan rumus berat ekivalen. Rumus berat ekivalen klorin adalah 35,5/1 = 35,5. Dengan rumus berat ekivalen ini, kita bisa menghitung berapa gram zat yang dibutuhkan untuk bereaksi dengan zat lain secara ekivalen. Misalnya, jika kita ingin bereaksi satu gram klorin dengan natrium (Na.

ALJABAR LINEAR DAN MATRIKS OBE OKE MATRIKS EKIVALEN
pH ekivalen adalah 7, sehingga kurva yang akan didapat: Bila dilakukan titrasi sebaliknya maka bentuk kurva dibalik menghadap kiri (mulai dari pH tinggi) 2. Titrasi asam kuat oleh basa lemah dan sebaliknya. pH ekivalen di bawah 7, sehingga bentuk kurvanya: Bila dilakukan titrasi sebaliknya (basa lemah oleh asam kuat) maka kurva dibalik.

Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
1. Mol ( n ) Simbol satuan : n Mol adalah massa (gram) suatu zat dibagi dengan massa molekul relatif / berat molekul suatu zat. Rumus : Dimana : n = mol suatu zat (mol) gr = massa suatu zat (gr) Mr = massa molekul relatif suatu zat (gr/mol) Mol ekivalen adalah jumlah mol dikali dengan jumlah ion H+ atau ion OH-

Cara Mencari Mr Kimia Homecare24
Massa ekivalen dari adalah.. ( A r Zn = 65 ). Reaksi diatas, jumlah elektronnya adalah 2. Massa ekivalennya (e) adalah: Jadi, jawaban yang benar adalah C. Perdalam pemahamanmu bersama Master Teacher di sesi Live Teaching, GRATIS! 9. 5.0 (1 rating) Iklan. Iklan. Klaim Gold gratis sekarang! Dengan Gold kamu bisa tanya soal ke Forum.
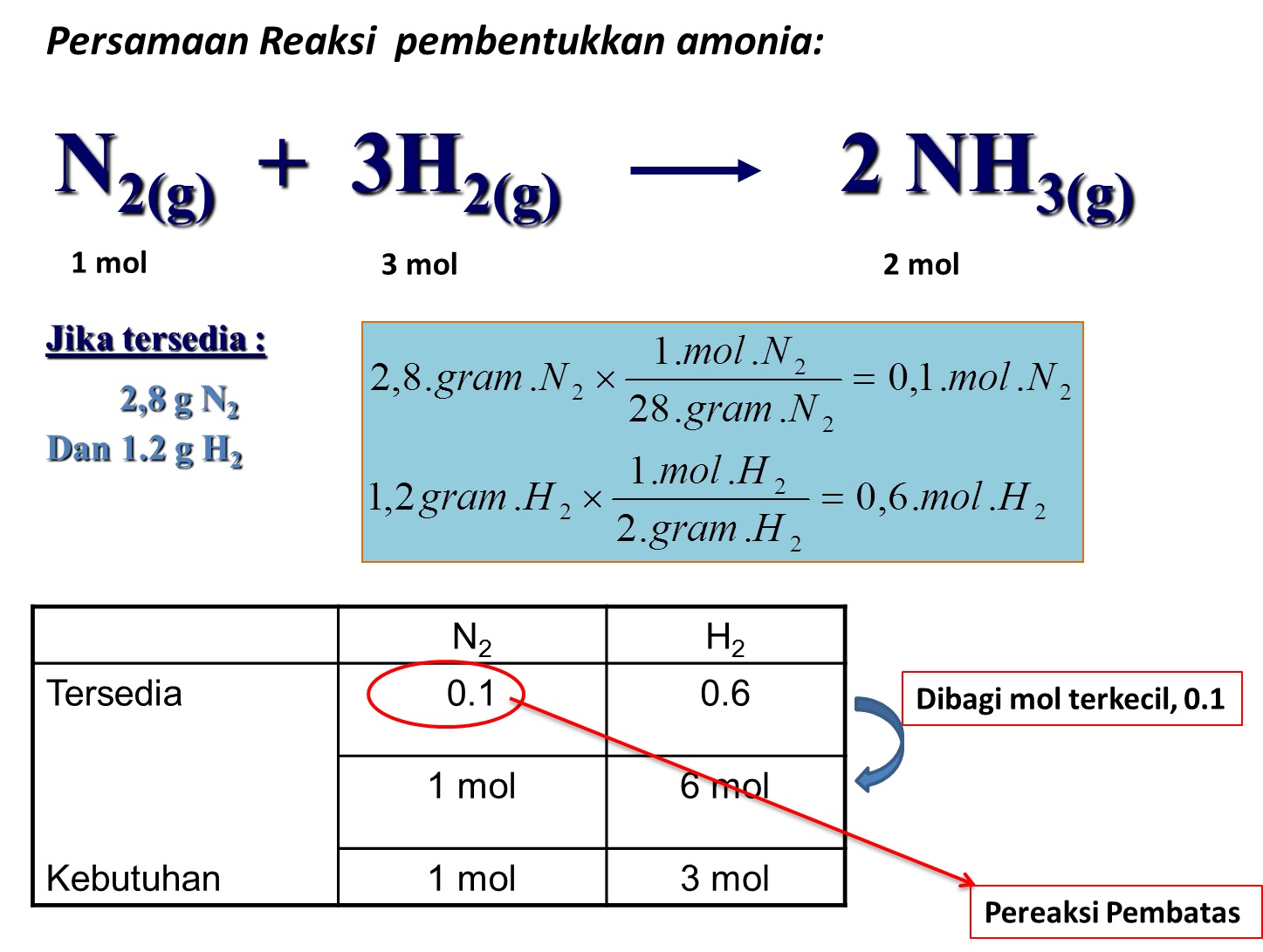
5 Tahapan Reaksi Kimia katelynjou.github.io
Massa atom relatif adalah angka yang menunjukkan berapa kali massa atom suatu elemen lebih berat dari massa atom hydrogen (H). Misalnya, massa atom relatif hydrogen adalah 1, sedangkan massa atom relatif oxygen adalah 16. 3. Hitung jumlah massa atom relatif dari masing-masing elemen dalam molekul zat tersebut.

BAB V HAMBATAN EKIVALEN RANGKAIAN SEDERHANA Hubungan Seri
Definisi. Konsentrasi ekivalen didefinisikan sebagai: = = Apabila z = 3, maka konsentrasi ekivalennya tiga kali lebih besar daripada molaritasnya. c eq menunjukkan berapa banyak substansi ekivalen yang dapat ditemukan di dalam volume larutan tertentu.. Satuan. Satuan yang umum digunakan untuk konsentrasi ekivalen adalah Mol/Liter. Larutan dengan c eq = 1 mol/L awalnya dianggap sebagai "larutan.

Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Dilansir dari Lumen Learning, massa ekivalen adalah massa molar dibagi dengan jumlah elektron yang diperlukan untuk mengoksidasi setiap unit zat. Hukum Faraday II dituliskan ke dalam rumus berikut: W1/W2 = e1/e2 Atau, dapat juga dituliskan sebagai: W1/ (Ar1/val1) = W2/ (Ar2/val2) (W1 x val 1)/Ar1 = (W2 x val 2)/Ar2

PERTEMUAN KE 13, KIMIA,CONTOH BERAT EKIVALEN YouTube
Massa ekivalen adalah massa bahan yang terdisosiasi atau berpartisipasi dalam reaksi redoks di elektroda per satu mol atau unit muatan listrik (1 faraday). Nilai ini spesifik untuk setiap bahan dan dapat dihitung berdasarkan reaksi redoks yang berlangsung.