
Tentukan pH dari 1 liter larutan NH4F 0,1 M jika diketahu...
Larutan asam klorida HCl 0,1 M dan H2SO4 harus disimpan pada tempat yang aman, terpisah dari bahan-bahan lain yang dapat membahayakan. Pastikan untuk menyimpannya dalam wadah yang tertutup rapat dan ditempatkan di tempat yang terpisah dari bahan-bahan lain. 13. Apa yang harus dilakukan jika terjadi tumpahan larutan asam klorida HCl 0,1 M dan.

Molalitas dari 100 mL larutan H2SO4 5 M adalah (Mr H2SO4
Sedangkan bahan yang digunakan adalah larutan HCl 0,1 M dan 1N, larutan H2SO4 0,1 M dan 1N, NaOH 0,1 N; 0,01 N; dan 0,001 N, aquades, kertas indicator pH, dan kertas lakmus merah dan lakmus biru. 3.3 Cara Kerja Adapun cara kerja dalam praktikum ini yaitu: 1. Disiapkan masing-masing larutan pada beaker glass. 2.

Dari hasil titrasi larutan NaOH 0,1 M dengan larutan HCl
Sedangkan bahan yang digunakan adalah larutan HCl 0,1 M dan 1N, larutan H2SO4 0,1 M dan 1N, NaOH 0,1 N; 0,01 N; dan 0,001 N, aquades, kertas indicator pH, dan kertas lakmus merah dan lakmus biru. 3.3 Cara Kerja Adapun cara kerja dalam praktikum ini yaitu: 1. Disiapkan masing-masing larutan pada beaker glass. 2.

Larutan HCL 0,1
N1.V1=N2.V2. 36.V1=1.1000. V1=1000.1/36. V1=27,8 ml. Jadi asam sulfat pekat yang dibutuhkan sebanyak 27,8 ml. Sehingga cara pembuatan asam sulfat ( H2SO4 ) 1 N sebanyak 1000 ml adalah : Isi labu takar ukuran 1 liter dengan aquadest kira-kira 250 ml, lalu tambahkan 27,8 ml asam sulfat pekat secara perlahan.

Jual Larutan Naoh Larutan Natrium Hidroksida N Normalitas My XXX Hot Girl
Larutan NaCN 0,1 M (Ka HCN = 4 x 10-6) b. CH3COONH4 0,1 M (KA CH3COONH4 = 1 x 10-5 dan Kb NH3 = 1 x 10-5) Contoh soal dan pembahasan KIMIA ERLANGGA Kelas 11 Latihan 5.3 Larutan asam basa

April 2015 JAGAD KIMIA
Berapa pH larutan yang terbentuk bila sebanyak 0,0600 mol NaOH ditambahkan ke dalam 1 L larutan HCl 0,0500 M. A. 3,45 B. 8,90 C. 12,00. Pembahasan dan jawaban: Volume larutan 500 mL = 0,5 L. M = 23,4 = 23,4 = 0,8 M. Volume uap air yang dapat ditambahkan pada 250 mL larutan H2SO4 0,3 M untuk mendapatkan larutan H2SO4 dengan konsentrasi 0,1.
[Sulfuric Acid solution (H2SO4) 황산용액 0.1M/1M 화)450㎖ ]
Sebagai contoh, 40 mL larutan HCl 0,1 M ditetesi dengan larutan NaOH 0,1 M sedikit demi sedikit. Berikut kurva titrasi yang menggambarkan perubahan pH selama titrasi tersebut.. V A, V B = volum larutan asam A dan basa B. Jika valensi dari asam A dan basa B yang bereaksi diketahui, konsentrasi larutan asam/basa juga dapat dicari dengan rumus.

Larutan Ha 0 1 M Lengkap
Jika 50 ml larutan CH3COOH 0,1 M dicampurkan dengan. Tentukan pH larutan dari campuran larutan berikut!a. 100. Dalam 2 liter larutan terdapat 0,2 mol amonium hidroksida. Perbandingan volume CH3COOH 0,1M (Ka=10^ (-5)M) dan NaOH 0. Perhatikan data percobaan berikut.Dari data tersebut yang. Untuk membuat larutan penyangga dengan pH=9.

Larutan NH4OH 0,1 M yang volumenya 400 mL ditambahkan ke dalam 200 mL larutan H2SO4, Mas Soal
Contoh Soal Derajat Keasaman Larutan dan Jawaban. Berikut ini adalah contoh soal tentang materi derajat keasaman dalam larutan: 1. Hitunglah pH larutan asam sulfat 0.05 M. Jawab: Asam sulfat (H2SO4) adalah asam kuat bervalensi 2. [H+] = Ma x a. = 0.05 x 2. = 0.1 mol/L.

SoalSoal Berapa pH Campuran 100 mL HCl 0,1 M dicampur dengan 150 mL H2SO4 0,1M Q&A YouTube
Pelajari tentang larutan HCl 0,1M dan larutan H2SO4 yang telah menjadi topik penting dalam dunia kimia. Dalam artikel ini, Anda akan mengetahui sifat, penggunaan, kelebihan, dan kelemahan masing-masing larutan. Pelajari bagaimana pengaruh larutan ini terhadap zat lain dan bagaimana mereka mampu meningkatkan kinerja reaksi kimia. Baca artikel lengkapnya di sini.

Sebanyak 50 mL larutan NaOH 1 M direaksikan dengan 100 mL larutan HCl 1 M, maka pH larutan
Larutan asam klorida HCl 0,1 M dan larutan H 2 SO 4 0,1 M dengan volume yang sama dicampur menjadi satu. Hitunglah pH campuranlarutan tersebut!

Larutan HCl 0,1 M sebanyak 100 mL dicampurkan dengan
Larutan asam klorida HCl 0,1 M memiliki berbagai penggunaan dan manfaat di laboratorium, di antaranya: Sebagai bahan kimia dalam sintesis organik dan anorganik. Sebagai bahan kimia dalam analisis kualitatif dan kuantitatif, seperti dalam analisis sisa. Sebagai bahan kimia dalam produksi pupuk, makanan, dan minuman.
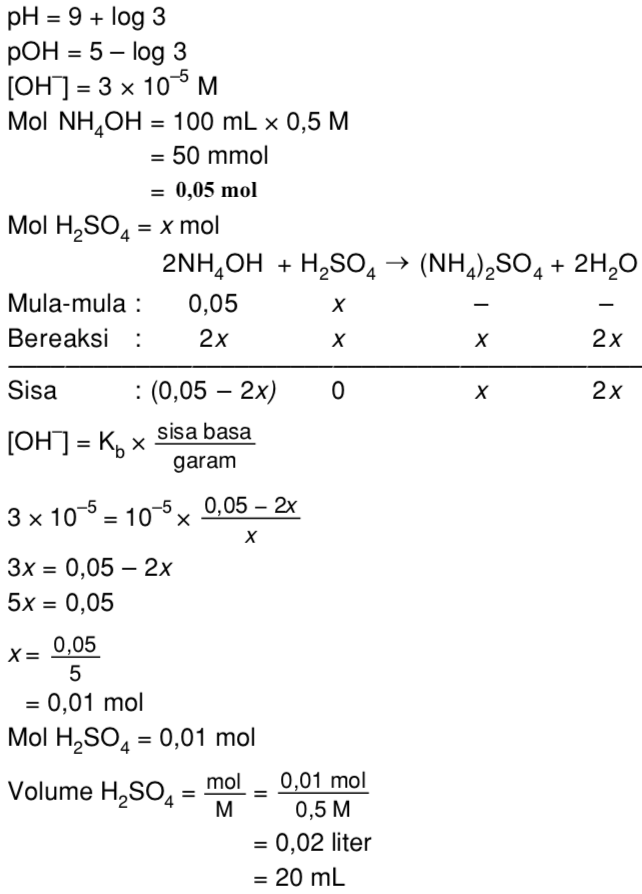
Berapa mL larutan H2SO4 0,5 M yang harus ditambahkan ke dalam 100 mL larutan NH4OH 0,5 M Mas Soal
Haiko friend pada saat ini Diketahui suatu larutan dibuat dengan mencampurkan 200 ml HCL 100 ml H2 so4 0,5 molar harga ph campuran tersebut adalah HCL merupakan ionisasi h2s merupakan asam kuat yang akan terionisasi menjadi 2 + + so4 2 minus isinya konsentrasi H plus campuran volume 1 dikali volume 2 bagai air yang kedua so4 volume campurannya adalah volumenya 200 volume 120 / 300 hasilnya.

Hitung volume larutan HCl 0,1 M yang ditambahkan ke dalam...
V1 = 0,1 . 100 0,1 𝑥 100 V1 = = 0,82 ml 12,06 Mengambil HCl sedikit demi sedikit dengan pipet ukur dan memasukkannya ke dalam labu ukur Menambahkan aquades sedikit demi sedikit ke dalam labu ukur hingga mencapai 100 ml dengan tetap memperhatikan meniskus bawah Menutup labu ukur dengan penutup Menghomogenkan 100 ml larutan HCl 0,1 M dari.

100 mL larutan HCl 0,1 M dicampurkan dengan 50 mL larutan...
Dimana a = jumlah H + dan Ma = Molaritas asam. Jadi, [H +] = 2 x 0,1 = 0,2 atau 2 x 10-1. pH = -log[H +] = -log. Larutan HA 0,1 M akan memberikan warna yang sama dengan larutan HCl 0,001 M jika ditetesi dengan indikator universal. Hitunglah nilai K a HA. 306. 4.6.

50 mL larutan H2SO4 0,1 M direaksikan dengan 50 mL NH4OH
kita memiliki campuran 50 ml HCL dengan konsentrasi 0,1 molar akan dinetralkan oleh larutan dengan berapa ML itu dengan mengalikan molaritas kali dengan volume hasil reaksi antara HCL menghasilkan NaCl + H2O adalah 1 banding 1 makacara sederhana kita bisa mengatakan bahwa 5 mili mol HCL itu dapat dinetralkan dengan 5 mili mol NaOH Kemudian yang kedua Mari kita H2 so4 dengan di mana jika kita.