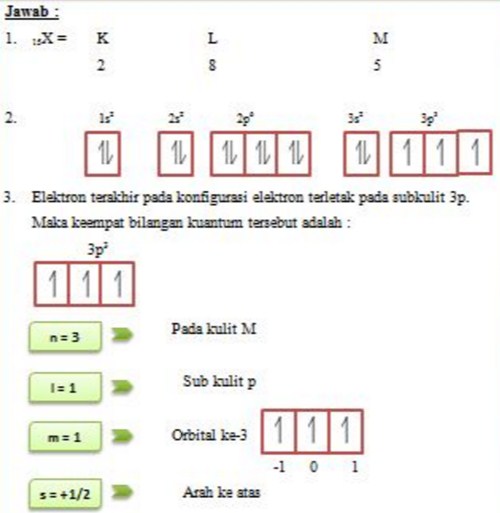
Konfigurasi Elektron Menurut Larangan Pauli Rumus Kimia
Teori Atom Bohr. Lintasan-lintasan elektron disebut juga dengan kulit elektron, yang ditempati oleh jumlah elektron maksimal. Dalam teori ini, konfigurasi elektron adalah pengisian elektron yang dimulai dari tingkat energi (kulit) paling rendah, yaitu kulit yang pertama kulit K, setelah kulit K sudah terisi penuh, dilanjutkan ke kulit L, kulit M, kulit N, hingga seterusnya.

Aturan Konfigurasi Elektron Dan Diagram Orbital Superprof
Nah sekarang kita akan menggambarkan konfigurasi elektron memakai diagram orbital, teman. Sebenarnya gambarnya cukup mudah kok. Suatu subkulit punya sejumlah orbital. Orbital itu digambarkan sebagai persegi dan berisi garis setengah panah yang mewakili elektron. Subkulit s punya 1 orbital, p punya 3 orbital, d punya 5 orbital, dan f 14 orbital.
Konfigurasi Elektron Pengertian, Cara Menentukan, & Contoh Soal
Dilansir dari E-book Kimia SMA/MA Kelas X, kecenderungan unsur-unsur lain mencapai konfigurasi stabil gas mulia (elektron valensi 8) disebut sebagai hukum oktet, sedangkan kecenderungan mencapai konfigurasi stabil gas mulia (elektron valensi 2) disebut hukum duplet. Suatu atom dapat mencapai kestabilan konfigurasi elektron atom gas mulia dengan cara melepaskan elektron, menerima atau menangkap.

Pengertian Konfigurasi Elektron Ilmu Kimia
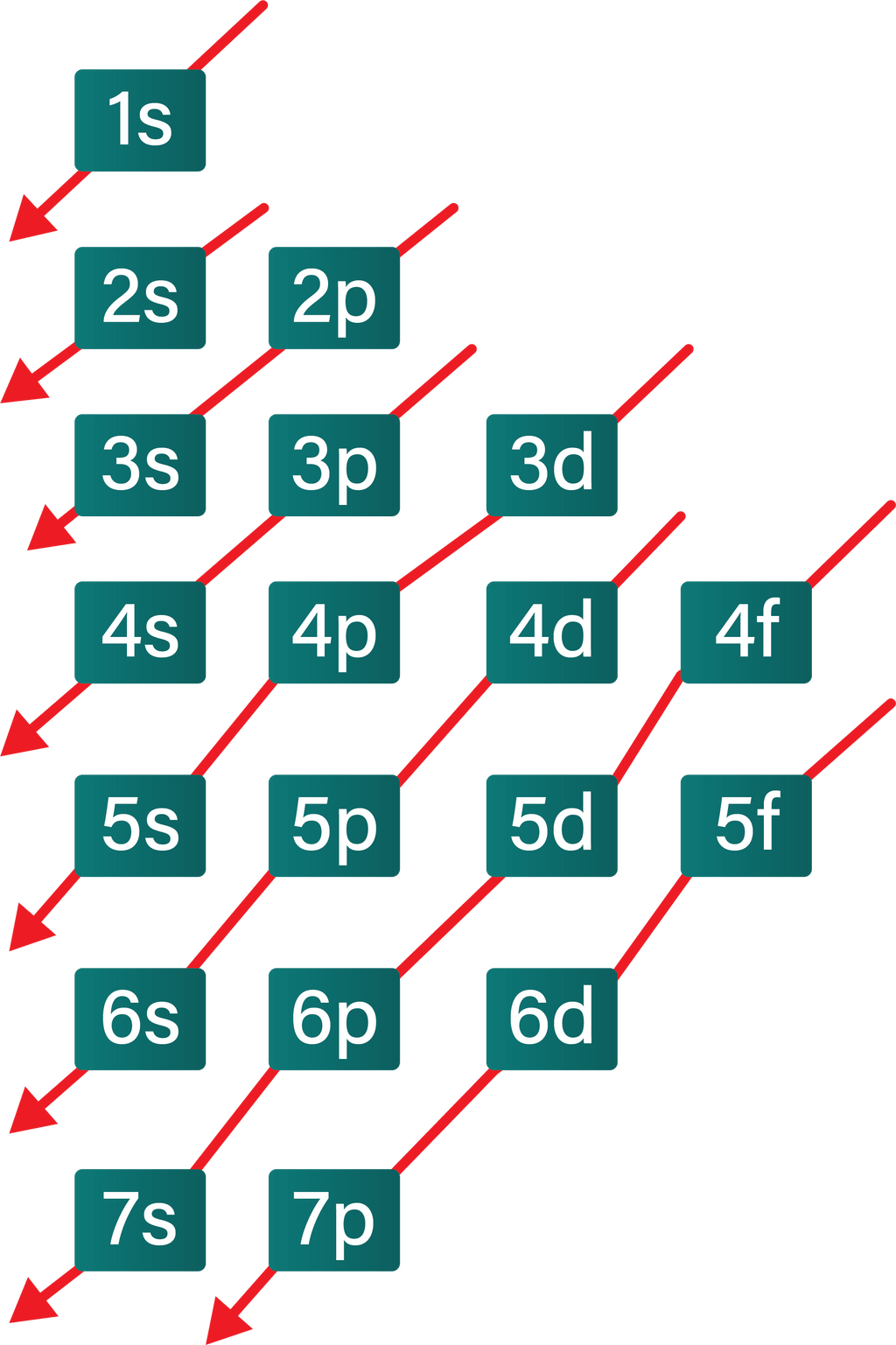
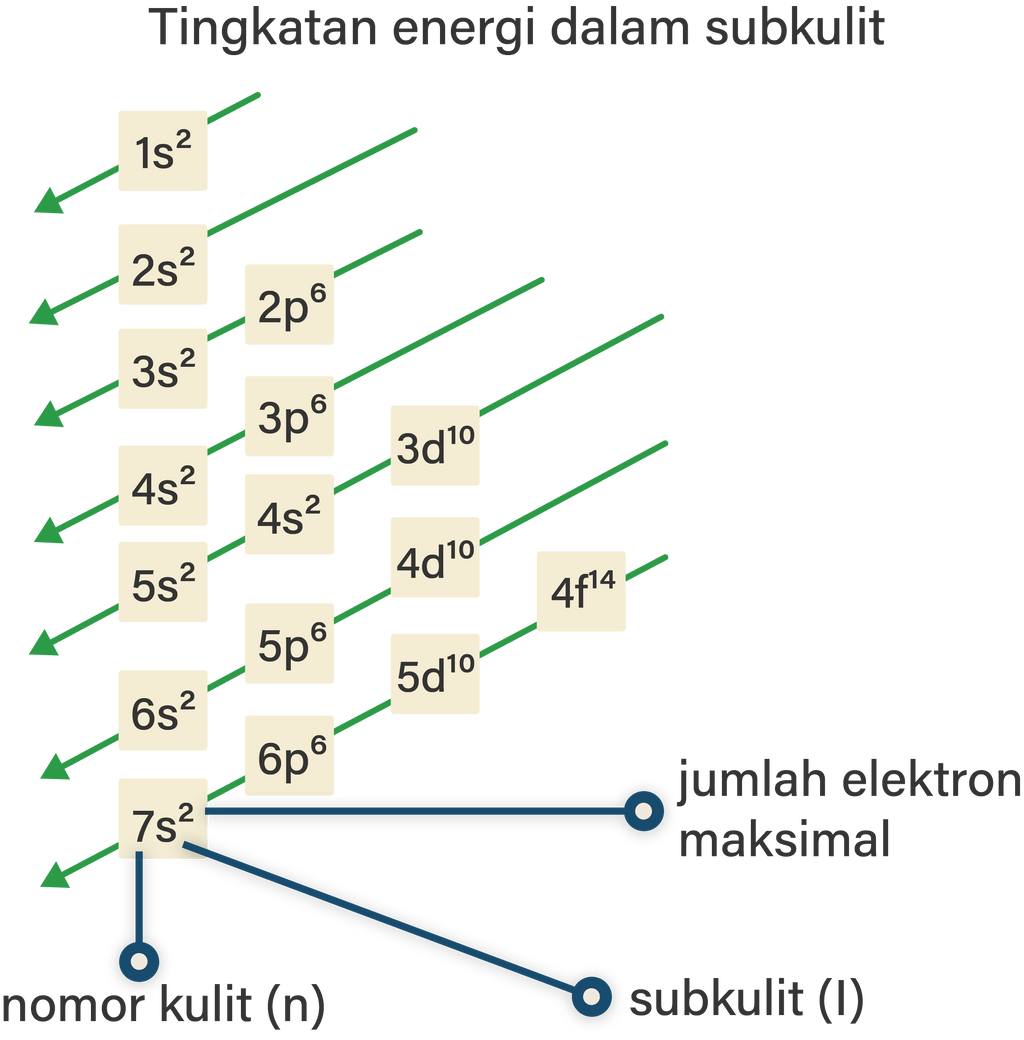
Aturan penentuan konfigurasi elektron berdasarkan orbital: 1. Asas Aufbau: Elektron menempati orbital-orbital dimulai dari tingkat energi yang terendah, dimulai dari 1s, 2s, 2p, dan seterusnya seperti urutan subkulit yang terlihat pada Gambar 2. Gambar 2. Urutan tingkat energi subkulit.

SoalJawab Menentukan Konfigurasi Elektron Tanya Soal
5. Bentuk Molekul H2O 1. Teori VSPER Jumlah elektron valensi atom pusat (oksigen) = 6 Jumlah pasangan elektron ikatan (X) = 2 Jumlah pasangan elektron bebas (E) = ( 6 - 2 ) : 2 = 2 Tipe molekulnya adalah AX2E2. Molekul H2O mengandung dua pasang electron ikatan dan dua pasang electron bebas Pasangan electron bebas yang terdapat pada H2O cenderung sejauh mungkin satu sama lain.
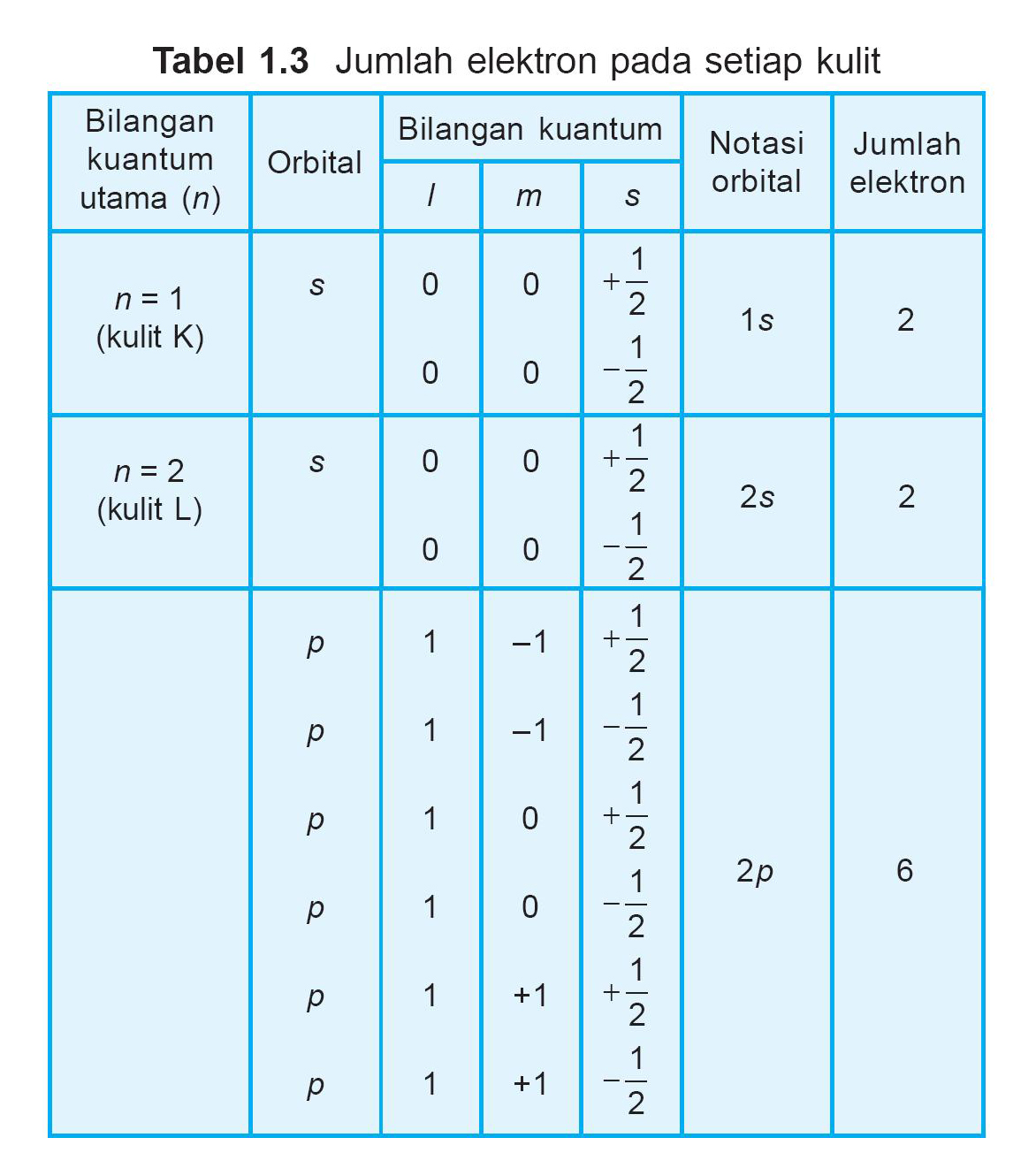
KIMIA "Konfigurasi elektron"
Banyaknya jumlah elektron terluar (elektron valensi) dari suatu atom menentukan sifat-sifat kimia suatu unsur. Konfigurasi elektron dapat dituliskan dengan cara: 1. Berdasarkan Kulit. Berdasarkan kulit, dapat digunakan rumus konfigurasi elektron 2n2 2 n 2, di mana n menunjukkan kulit atom. Contoh: 11Na 11 N a: 2, 8, 1.

Konfigurasi elektron ion soal kimia SMA YouTube
Konfigurasi elektron menjadi salah satu materi yang ada dalam mata pelajaran kimia untuk kelas X (sepuluh) Sekolah Menengah Atas (SMA). Dalam kimia, konfigurasi elektron merupakan julukan untuk susunan elektron yang terbentuk pada kulit atom. Fungsi dari konfigurasi elektron adalah untuk menentukan sifat dan penempatan atom pada sistem periodik.

KONFIGURASI ELEKTRON TEORI ATOM BOHR YouTube
Cara Menentukan Konfigurasi Elektron. Secara umum untuk menentukan konfigurasi elektron yang perlu dilakukan adalah dengan menentukan jumlah elektron dalam atom ataupun ion terlebih dahulu. Jumlah elektron dapat diketahui dari nomor atomnya. Selanjutnya kita perlu memasukkan elektron ke dalam suborbital dalam urutan yang benar.
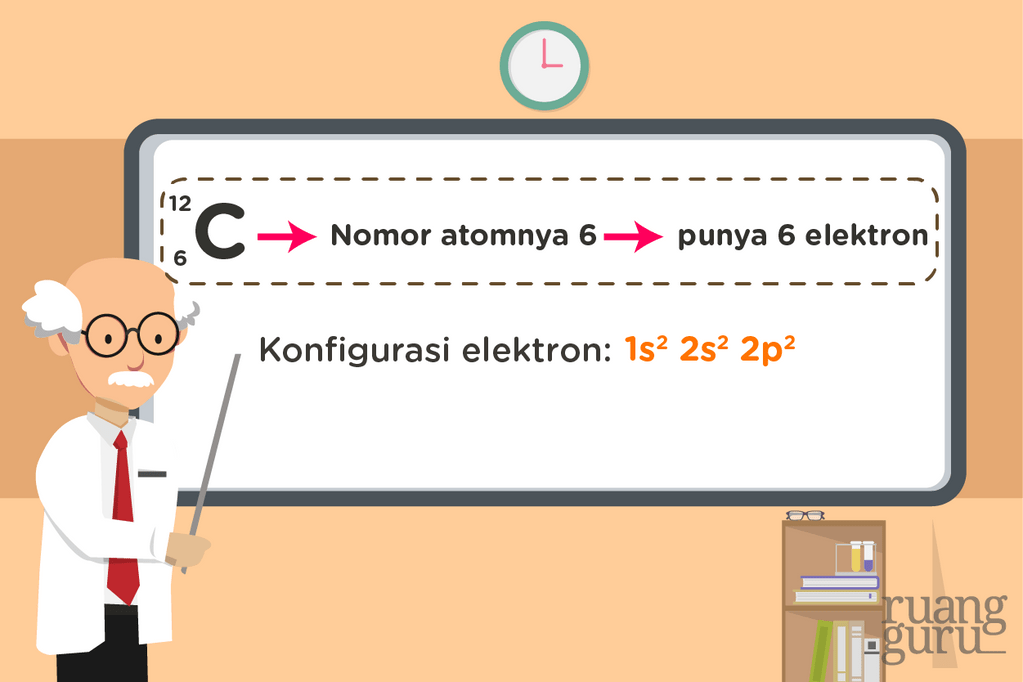
Memahami Konfigurasi Elektron dan Diagram Orbital Lebih Mudah Kimia Kelas 10
Penulisan konfigurasi elektron dapat secara panjang (sesuai aturan Aufbau) dan dapat secara singkat. Contoh penulisan konfigurasi elektron secara singkat yang didasarkan pada konfigurasai gas mulia yaitu seperti pada tabel berikut. Unsur Konfigurasi Elektron Penyingkatan; 7 N: 1s 2 2s 2 2p 3 [He] 2s 2 2p 3: 12 Mg: 1s 2 2s 2 2p 6 3s 2

Konfigurasi Elektron Berdasarkan Orbital YouTube
Pengertian Konfigurasi Elektron. Konfigurasi elektron adalah susunan elektron di dalam atom. Sejatinya, elektron merupakan partikel bermuatan negatif yang berputar mengitari inti atom. Gambaran mudahnya, inti atom dianalogikan sebagai Matahari. Nah, elektron dianalogikan sebagai planet-planet yang berputar mengelilingi Matahari tersebut.

Konfigurasi Elektron Ion Panduan Lengkap dan Terperinci
Tabel konfigurasi elektron. Konfigurasi elektron adalah susunan elektron-elektron yang terdapat pada suatu unsur. Konfigurasi elektron dituliskan berdasarkan aturan yang telah disepakati oleh ilmuan-ilmuan terkemuka. Aturan-aturan dalam penulisan konfigurasi elektron antara lain yaitu prinsip aufbau, kaidah hund, larangan pauli, serta hukum mekanika kuantum.

Memahami Konfigurasi Elektron dan Diagram Orbital Lebih Mudah Kimia Kelas 10
The first stage of this process is: Fe(H 2O)3 + 6 + H 2O − ⇀ ↽ − Fe(H 2O) 5(OH)2 + + H 3O +. The complex ion is acting as an (Arrhenius) acid by donating a hydrogen ion to water molecules in the solution. The water is, of course, acting as a (Arrhenius) base by accepting the hydrogen ion. Because of the confusing presence of water from.
Unsur 19 39 K mempunyai konfigurasi elektron
Konfigurasi elektron sebuah atom merupakan representasi numerik dari orbit elektron tersebut. Orbit elektron merupakan wilayah-wilayah yang berbeda bentuk di sekitar nukleus atom, di mana elektron biasanya terdapat. Sebuah konfigurasi elektron dapat memberitahu pembaca tentang jumlah orbit elektro yang dimiliki sebuah atom, juga jumlah elektron yang menempati setiap orbitnya.
aturan konfigurasi elektron Ilmu Kimia
n: jumlah PEI dalam molekul. E: pasangan elektron bebas (PEB) m: jumlah PEB dalam molekul. Ada 11 bentuk molekul berdasarkan teori domain elektron, yaitu linear, segitiga planar, segiempat piramida, seesaw atau jungkat-jungkit, bentuk T, oktahedral, bentuk bengkok, tetrahedral, segitiga piramida, bentuk V, dan segitiga bipiramida.
Jelaskan tentang konfigurasi elektron beserta cont...
Video: Fe, Fe2+, and Fe3+ Electron Configuration Notation. In writing the electron configuration for Iron the first two electrons will go in the 1s orbital. Since 1s can only hold two electrons the next 2 electrons for Iron go in the 2s orbital. The next six electrons will go in the 2p orbital. The p orbital can hold up to six electrons.

Penjelasan Konfigurasi Elektron Secara Lengkap
Buku ini mengandung prediksi konfigurasi elektron untuk unsur-unsur 119-172 dan 184, berdasarkan relativistik Dirac-Fock kalkulasi oleh B. Fricke dalam Fricke, B. (1975). Dunitz, J. D., ed. Structure and Bonding. Berlin: Springer-Verlag. 21: 89-144.