
Konfigurasi Elektron Berdasarkan Orbital YouTube
Larangan Pauli Berdasarkan larangan Pauli, dalam suatu atom tidak boleh terdapat dua elektron yang memiliki keempat bilangan kuantum yang sama. Sehingga apabilai dua elektron menempati orbital yang sama, maka bilangan kuantum spin dua elektron ini harus berbeda Nomor atom S = 16, konfigurasinya adalah sebagai berikut: 16 S = 1s^2 2s^2 2p^6 3s^2.

Penjelasan Konfigurasi Elektron Secara Lengkap
Konfigurasi elektron 16s adalah susunan elektron pada kulit atom nomor atom 16, yang terdiri dari 16 elektron yang terbagi dalam beberapa subkulit. Konfigurasi elektron 16s merupakan bagian dari konfigurasi elektron suatu atom yang menentukan sifat kimia dan fisika dari unsur tersebut.

Cara menulis konfigurasi elektron dan mengisi diagram orbital YouTube
Konfigurasi elektron menyatakan tata letak elektron dalam atom. Dari konfigurasi elektron, kita dapat menentukan nomor atom, golongan dan periode unsur dalam tabel periodik, serta diagram orbital elektronnya.. atom 16. Ion sulfida, S − 2 adalah unsur sulfuryang menerima 2elektron dari luar, sehingga total elektronnya adalah 16 + 2 = 18.

Aturan Konfigurasi Elektron Dan Diagram Orbital Superprof
Dari tabel di atas dapat kita ketahui bahwa elektron valensi dari Lithitum (3 Li) adalah 1 dan elektron valensi dari Sulfur (16 S) adalah 6. B. Aturan dalam Konfigurasi Elektron. Berdasarkan model atom mekanika kuantum, terdapat tiga aturan yang berlaku pada konfigurasi elektron yaitu: Asas larangan Pauli (Wolfgang Linus Pauli (1926))

Cara Cepat Menuliskan Konfigurasi Elektron, Golongan, dan Periode YouTube
Konfigurasi Elektron Gas Mulia.. [Ar] 4s2 3d8 dan jumlah elektron pada setiap kulit adalah K berjumlah 2, L berjumlah 8, M berjumlah 16 dan N berjumlah 2Sr (Z = 38) maka konfigurasinya adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d8 5s2 atau [Kr] 5s2 dan jumlah elektron pada setiap kulit adalah K berjumlah 2, L berjumlah 8, M berjumlah 18, N berjumlah 2.

Nomor atom S = 16, jadi konfigurasi elektron ion sulfida, S2 adalah YouTube
16s konfigurasi elektron adalah struktur elektron yang terdiri dari 16 elektron yang ditata sesuai dengan prinsip-prinsip susunan elektron pada tabel periodik. Konfigurasi ini digunakan dalam berbagai penelitian, mulai dari penelitian kimia hingga biologi. Dalam artikel ini, kita akan membahas secara detail tentang 16s konfigurasi elektron, kelebihan, kekurangan, dan informasi lengkap yang.
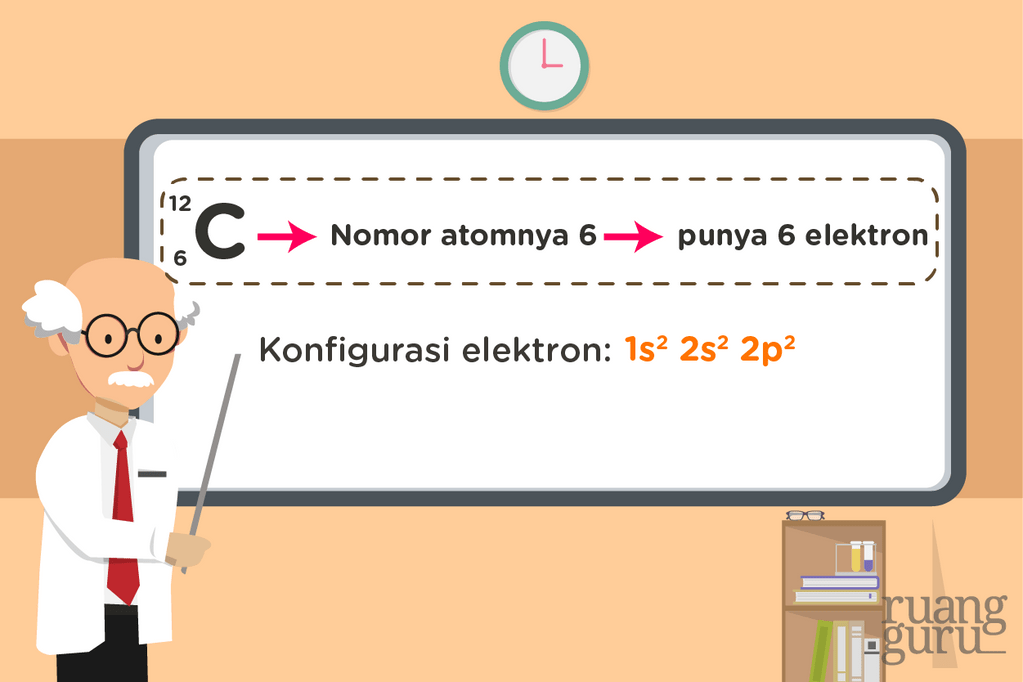
Memahami Konfigurasi Elektron dan Diagram Orbital Lebih Mudah Kimia Kelas 10
Cara Konfigurasi Elektron Anion Sulfur "16S" (Cara Mekanika Kuantum)Buat kamu yang ingin menonton Video Edukasi Kimia lainnya, bisa 👉 Subcribe: https://yout.
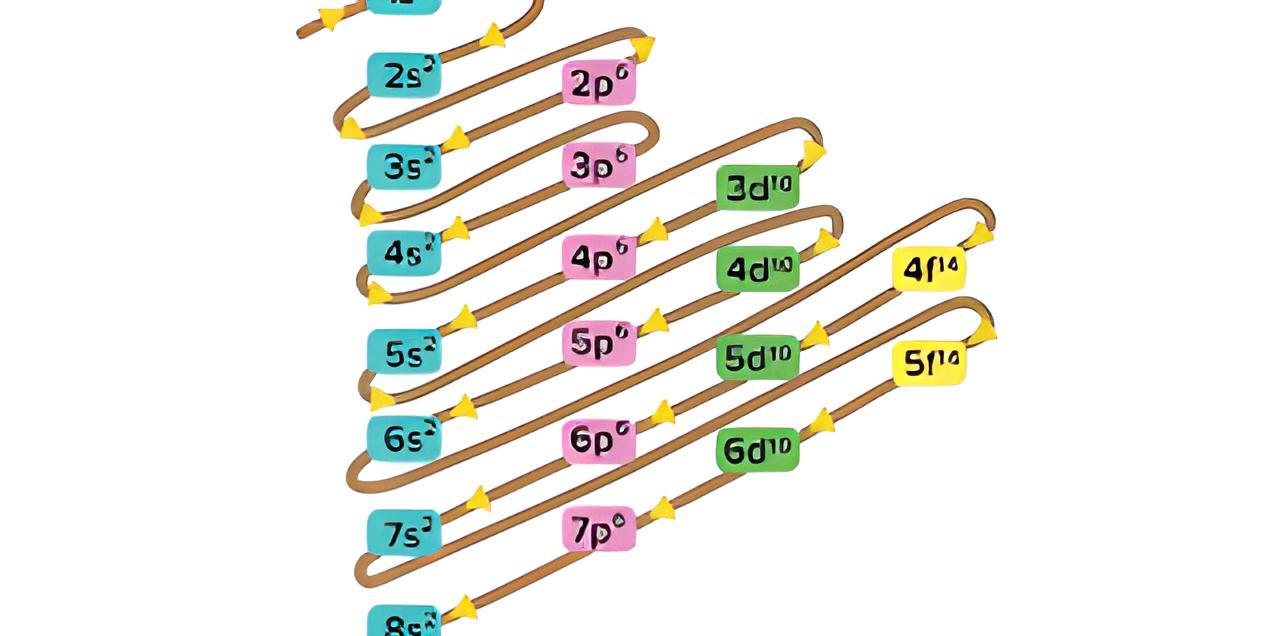
Aturan Konfigurasi Elektron Dan Diagram Orbital Superprof
Jumlah elektron maksimal yang menempati subkulit atom adalah 2 untuk subkulit s, 6 untuk subkulit p, 10 untuk subkulit d, dan 14 untuk subkulit f. Sehingga lebih lengkapnya, konfigurasi elektron mengikuti urutan berikut. 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2 4f 14 5d 10 6p 6 7s 2 5f 14 6d 10 7p 6. Contoh: 16 S : 1s 2 2s.

Cara Konfigurasi Elektron Anion Sulfur "16S" (Cara Mekanika Kuantum) YouTube
Tabel konfigurasi elektron. Konfigurasi elektron adalah susunan elektron-elektron yang terdapat pada suatu unsur. Konfigurasi elektron dituliskan berdasarkan aturan yang telah disepakati oleh ilmuan-ilmuan terkemuka.. 16: Belerang (S) 1s 2 2s 2 2p 6 3s 2 3p 4: 17: Klorin (Cl) 1s 2 2s 2 2p 6 3s 2 3p 5: 18: Argon (Ar) 1s 2 2s 2 2p 6 3s 2 3p 6:.

Pengertian Konfigurasi Elektron Ilmu Kimia
Banyaknya jumlah elektron terluar (elektron valensi) dari suatu atom menentukan sifat-sifat kimia suatu unsur. Konfigurasi elektron dapat dituliskan dengan cara: 1. Berdasarkan Kulit. Berdasarkan kulit, dapat digunakan rumus konfigurasi elektron 2n2 2 n 2, di mana n menunjukkan kulit atom. Contoh: 11Na 11 N a: 2, 8, 1.

Memahami Konfigurasi Elektron dan Diagram Orbital Lebih Mudah Kimia Kelas 10
Konfigurasi elektron dalam atom, bisa diungkapkan dengan diagram curah hujan dan diagram orbital.. Kulit M (n =3) maksimal menampung 2.23 = 16, hingga seterusnya. Untuk menuliskan konfigurasi elektron suatu atom, yaitu dengan cara mengetahui jumlah elektron suatu atom yang ditunjukkan melalui nomor atom. Teori Mekanika Kuantum.
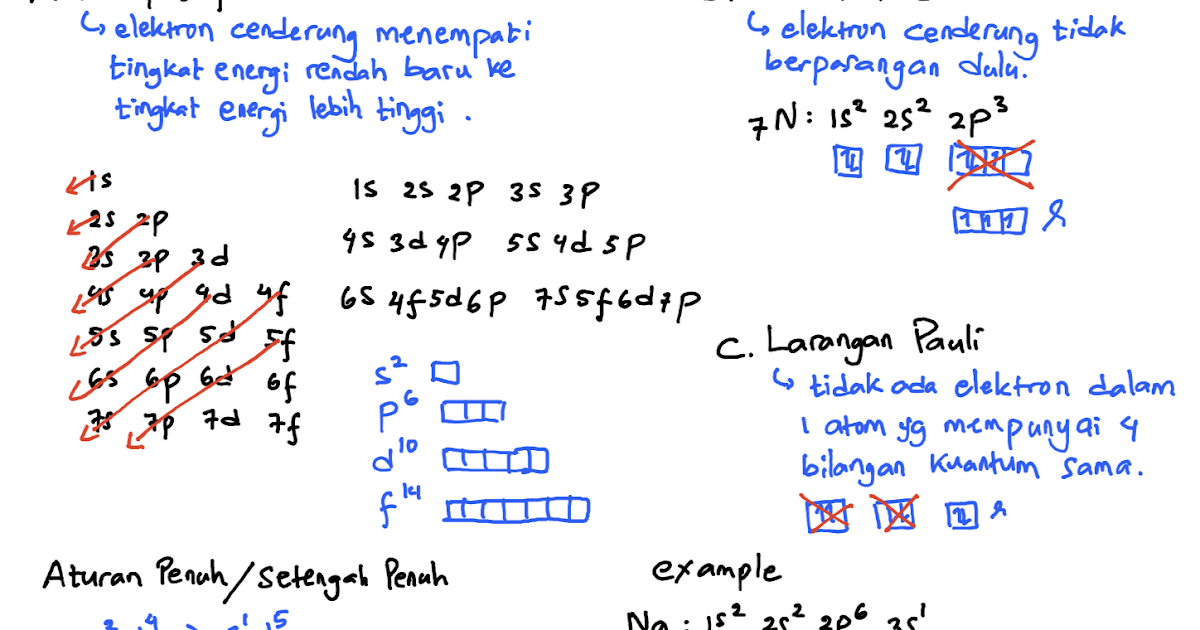
Konfigurasi Elektron
Nah sekarang kita akan menggambarkan konfigurasi elektron memakai diagram orbital, teman. Sebenarnya gambarnya cukup mudah kok. Suatu subkulit punya sejumlah orbital. Orbital itu digambarkan sebagai persegi dan berisi garis setengah panah yang mewakili elektron. Subkulit s punya 1 orbital, p punya 3 orbital, d punya 5 orbital, dan f 14 orbital.

Konfigurasi Elektron Dalam Orbital Untuk Unsur 18Ar Adalah Ujian
Información del edificio en Calle Manuel Tovar, 16, Madrid. Datos públicos obtenidos de la Dirección General de Catastro y de la base de datos de idealista. 1.146 m² de parcela. 1 Garaje/Trastero. 2 Oficinas. Publicidad.

Konfigurasi Elektron
Konfigurasi Elektron [Ne]3s 2 2p 4: Titik Didih: 717,82 K: Titik Lebur: 392,2 K: Massa Jenis: 2,07 g/cm 3: Struktur Kristal: Orthorombic: Elektronegativitas: 2,58: Radius Atom:. Belerang - Sulfur (16 S) Belerang atau sulfur adalah unsur kimia dalam tabel periodik yang memiliki lambang S dan nomor atom 16. Belerang merupakan unsur non-logam.
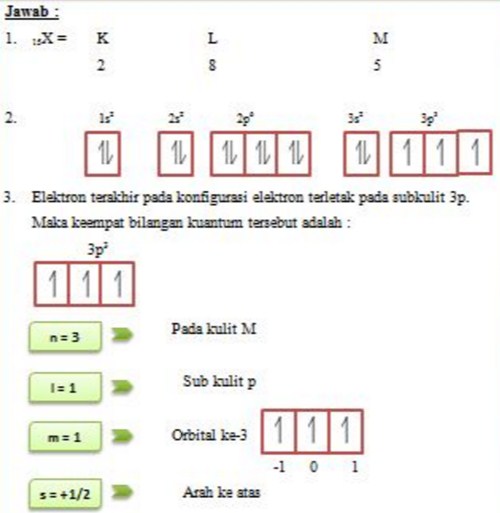
Konfigurasi Elektron Menurut Larangan Pauli Rumus Kimia
Konfigurasi elektron adalah susunan penyebaran (pengisian) elektron-elektron dalam.. L = 8 ; M = 16 ; N = 2; Sr (Z = 38) : 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 atau [Kr] 5s 2; K = 2 ; L = 8 ; M = 18 ; N = 8 ; O = 2; Berdasarkan eksperimen, terdapat anomali konfigurasi elektron dari aturan-aturan di atas. Subkulit d memiliki tendensi.
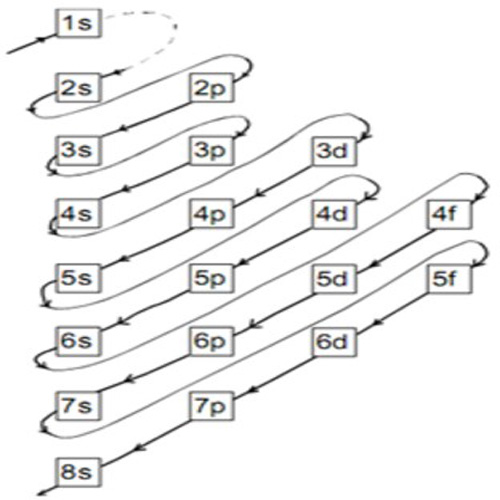
Pengertian Konfigurasi Elektron Rumus Kimia
Konfigurasi elektron 16s merupakan susunan elektron pada kulit ke-2 suatu atom. Konfigurasi ini memainkan peranan penting dalam menentukan sifat kimia suatu unsur. Dengan memahami konfigurasi elektron 16s, kita dapat menjelaskan sifat kimia, reaktivitas, dan kestabilan atom tersebut. Pelajari lebih lanjut tentang konfigurasi elektron 16s dan bagaimana ia mempengaruhi sifat atom di dalam.