Daftar Asam Basa Kuat Dan Lemah
Larutan penyangga dikenal dengan nama atau biasa disebut sebagai larutan buffer adalah larutan yang mengandung asam lemah dan basa konjugasinya atau basa lemah dan asam konjugasinya. pH larutan buffer praktis tidak berubah walaupun kepadanya ditambahkan sedikit asam kuat atau basa kuat atau bila larutan diencerkan. Buffer Asam & Buffer Basa
Teori Asam Dan Basa Menurut Arrhenius, BronstedLowry, dan Lewis ezy blog
Contoh basa lemah adalah amonia. Ia tidak mengandung ion hidroksida, tetapi bereaksi dengan air untuk menghasilkan ion amonium dan ion hidroksida. [4] Posisi keseimbangan bervariasi dari satu basa ke basa lain ketika basa lemah bereaksi dengan air. Semakin jauh ke kiri itu, semakin lemah basanya.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
Kalium hidroksida (KOH) adalah basa kuat, yang digunakan dalam industri untuk menetralisir asam kuat dan lemah, untuk mengendalikan pH dan untuk pembuatan garam kalium. Basa ini juga digunakan untuk menyabunkan lemak dan minyak, dalam pembersih industri, dan dalam reaksi hidrolisis, misalnya untuk ester.
PPT ASAM DAN BASA PowerPoint Presentation, free download ID1244635
KOH, atau kalium hidroksida, dianggap sebagai basa kuat karena kemampuannya untuk berdisosiasi sempurna dari ion-ion penyusunnya dalam air. Ketika KOH dilarutkan dalam air, ia terurai menjadi ion kalium (K+) dan ion hidroksida (OH-). Proses ini diwakili oleh persamaan kimia berikut: KOH (s) + H2O (l) → K+ (aq) + OH- (aq) Ion hidroksida (OH.

Reaksi Asam Basa Rumus Kimia Contoh Soal Dan Jawaban Riset
Termasuk larutan basa kuat adalah : NaOH, Mg (OH)2, KOH, Ca (OH)2, Sr (OH)2. Sedangkan yang dimaksud larutan basa lemah adalah yang memiliki ciri-ciri : Larutan tersebut sulit terion. Memiliki ikatan antar ion yang sulit lepas. Ikatan antar ion sulit lepas karena jarak antar inti atom pada molekul yang sangat dekat.

MENGHITUNG pH BASA KUAT DAN BASA LEMAH YouTube
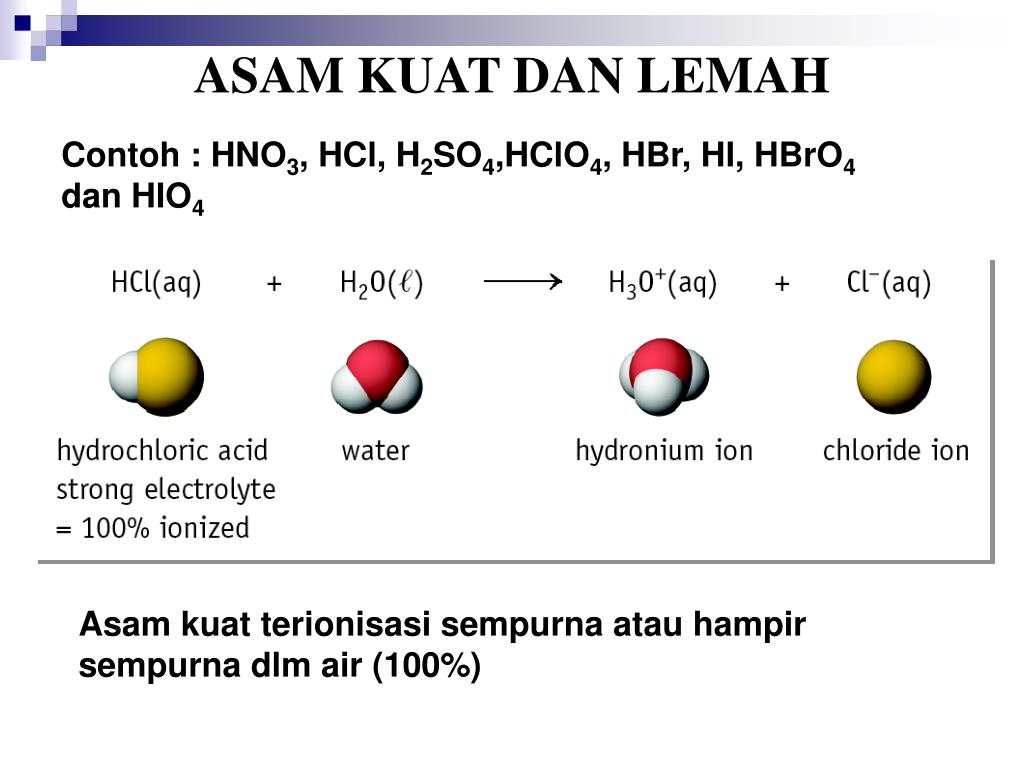
Basa Kuat. Basa kuat adalah larutan yang menghasilkan banyak ion dan terurai secara sempurna saat dilarutkan dalam air. Karena terionisasi sempurna, sehingga derajat ionisasinya (α=1). Contohnya adalah NaOH, KOH, LiOH, dan Ba(OH)2. Berikut ini merupakan rumus ionisasi basa kuat: [OH-] = x . [M(OH)x] atau, [OH-] = valensi basa . M. Basa Lemah.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 36
03 Maret 2023 Lili Y. Bagikan. 28 Contoh Asam Basa Kuat dan Asam Basa Lemah Beserta Reaksi Ionisasinya - Ketika kamu menambahkan soda kue ke cuka, maka akan menyebabkan gelembung dan busa. Ini merupakan reaksi antara asam dan basa. Asam dan basa dicirikan oleh pertukaran ion hidrogen. Asam adalah molekul yang menyumbangkan satu ion hidrogen.

sifat bahan asam dan basa Rose Welch
Kekuatan basa alkali tidak berkaitan dengan seberapa kaustiknya hidroksida tersebut. Dilansir dari Chemistry LibreTexts, kekuatan basa adalah ukuran seberapa mudahnya molekul terionisasi dalam air. Baca juga: Daftar Nama Asam-Basa Kuat dan Asam-Basa Lemah. Basa yang paling kuat adalah basa yang paling mudah terionisasi dalam air. Artinya, makin.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 34
Sedangkan basa kuat adalah senyawa basa yang mudah melepaskan ion OH - dalam air dan mengalami disosiasi total dalam larutannya. Contoh basa kuat yaitu NaOH, KOH, dan Ba(OH) 2. 2. Asam Lemah dan Basa Lemah. Asam lemah adalah senyawa asam yang sulit melepaskan ion H + dalam air dan mengalami disosiasi sebagian dalam larutannya.

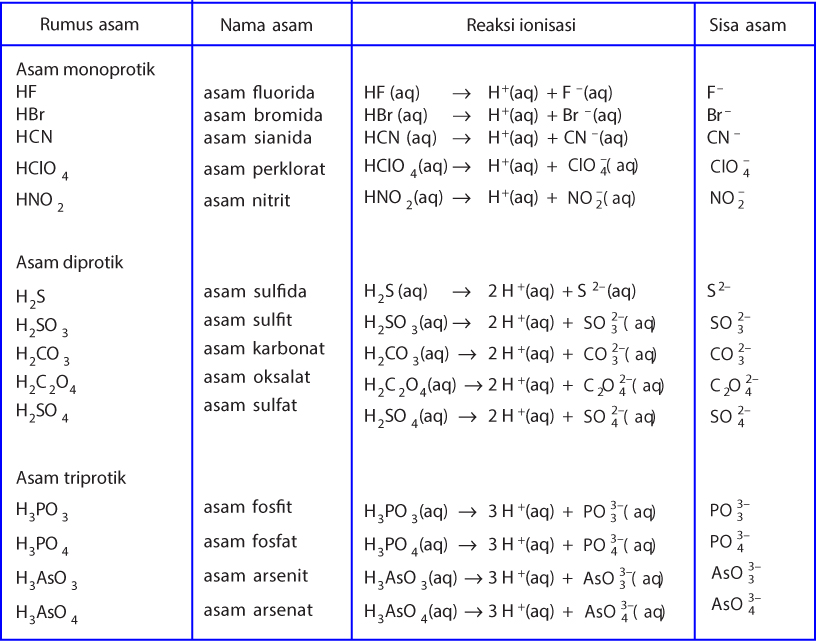
Daftar Nama Asam Basa Kuat Dan Lemah
Berikut adalah pengertian dan contoh dari basa kuat dan basa lemah! Basa kuat. Dilansir dari Chemistry LibreTexts, basa kuat adalah basa yang terionisasi secara sempurna ke dalam air. Ketika larut dalam air, setiap molekul basa kuat akan melepaskan ion hidroksida (OH-). Basa kuat memiliki pH yang tinggi, biasanya lebih besar dari 11.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Basa Kuat. Pengertian basa kuat ialah jenis senyawa yang melepaskan proton (deprotonasi) pada asam sangat lemah secara sederhana dalam reaksi asam basa. Adapun contoh basa kuat yang paling umum ialah Hidroksida pada logan alkali, misalnya Ca (OH)2 maupun NaOH.

Kekuatan Asam Basa Kuat & Lemah Kimia Kelas XI YouTube
Umumnya sukar larut dalam air kecuali NH4OH, KOH, NaOH, Ba(OH)2, Sr(OH)2, Ca(OH)2.-Basa kuat Pengertian basa kuat adalah senyawa basa yang akan terurai sempurna jika terlarut dalam air. Misalnya pada senyawa: NaOH, KOH, Ba(OH)2.-Basa lemah Pengertian basa lemah adalah senyawa basa yang tidak sempurna proses pelarutan atau terurainya jika ada.

TITRASI ASAM BASA (PART 2), ASAM LEMAH DITITRASI BASA KUAT YouTube
Berikut adalah cara atau metode dalam rangkuman titrasi asam basa lengkap sebagai berikut.. Titrasi asam kuat oleh basa lemah dan sebaliknya pH ekivalen di bawah 7, sehingga bentuk kurvanya:. Sebanyak 10 mL dari larutan tersebut diambil dan dititrasi dengan KOH 0,1 M. Dari hasil eksperimen ditemukan bahwa peniter berkurang sebanyak 20 mL.

Tabel Asam Lemah dan Basa Lemah
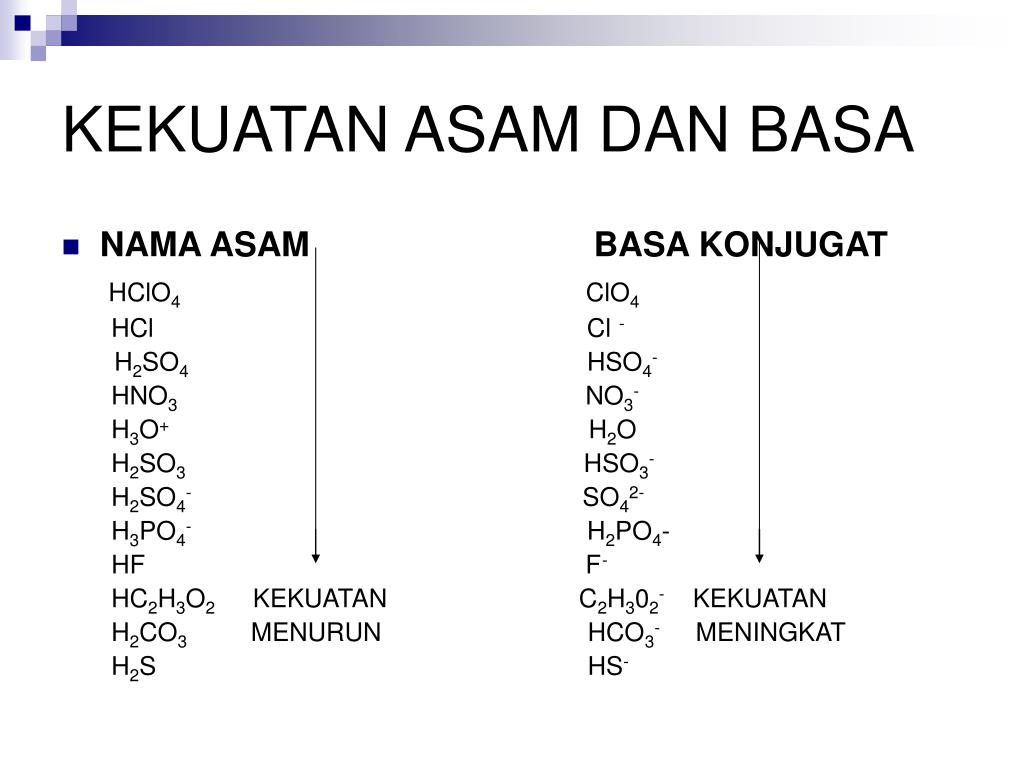
Kation dari basa kuat di atas terdapat pada grup pertama dan kedua pada daftar periodik (alkali dan alkali tanah). Asam dengan pK a lebih dari 13 dianggap sangat lemah, dan basa konjugasinya adalah basa kuat. Beberapa basa kuat seperti kalsium hidroksida sangat tidak larut dalam air. Hal itu bukan suatu masalah - kalsium hidroksida tetap.

Kekuatan Asam dan Basa dalam Kimia Organik
Oleh karena itu, larutan garam dari asam lemah dan basa kuat akan meningkatkan konsentrasi OH − dalam air sehingga larutannya bersifat basa (pH > 7).. Garam dari asam lemah dan basa lemah. Garam seperti CH 3 COONH 4 yang dapat terbentuk dari reaksi asam lemah (CH 3 COOH) dan basa lemah (NH 3) akan mengalami hidrolisis kation dan anionnya. pH larutan garam demikian bergantung pada kekuatan.
Asam Basa ( Kuat & Lemah )
1. Asam asam merupakan salah satu penyusun dari berbagai bahan makanan dan minuman, misalnya cuka, keju, dan buah-buahan. Menurut Arrhenius, asam adalah zat yang dalam air akan melepaskan ion H+. Jadi, pembawa sifat asam adalah ion H+ (ion hidrogen), sehingga rumus kimia asam selalu mengandung atom hidrogen. Ion adalah atom atau sekelompok atom.