
Halaman Unduh untuk file Gambar Rangkaian Sel Volta Dan Penjelasannya yang ke 6
Sel volta adalah sebuah alat yang dapat mengubah cairan kimia menjadi energi listrik. Alat ini dikenal dengan istilah sel elektrokimia. Nah, sel volta terdiri dari 4 bagian yaitu: Voltmeter, Jembatan Garam, Anoda, dan Katoda. Voltmeter: komponen yang berfungsi menentukan besarnya potensial pistrik atau tegangan listrik yang dihasilkan.
Kelas XII (KIMIA) Elektrokimia Konsep Dan Sel Volta (Part 1) Kirius Ilmu
Sel Volta: Pengertian, Contoh dan Prinsip Kerjanya. Kholida Qothrunnada - detikEdu. Kamis, 21 Okt 2021 14:48 WIB. Prinsip kerja sel volta (Foto: shutterstock) Jakarta -. Sel volta disebut juga dengan sel galvani. Penamaan keduanya tersebut, diambil dari nama penemunya yaitu seorang ilmuan bernama Alessandro Guiseppe Volta. dan Luigi Galvani.

Contoh Sel Volta Dalam Kehidupan Seharihari Riset
3 KESIMPULAN. Dari uraian di atas, dapat disimpulkan bahwa sel volta adalah elektrokimia dimana energi kimia diubah menjadi energi listrik. Sel volta melibatkan reaksi redoks dan menghasilkan arus listrik. Sel volta selalu terbentuk dari dua elektroda dengan Eº yang berbeda.. Automasi Industri ini dengan judul " SEL VOLTA ".

NOTASI SEL DAN POTENSIAL SEL (SEL VOLTA KIMIA SMA KELAS 12) YouTube
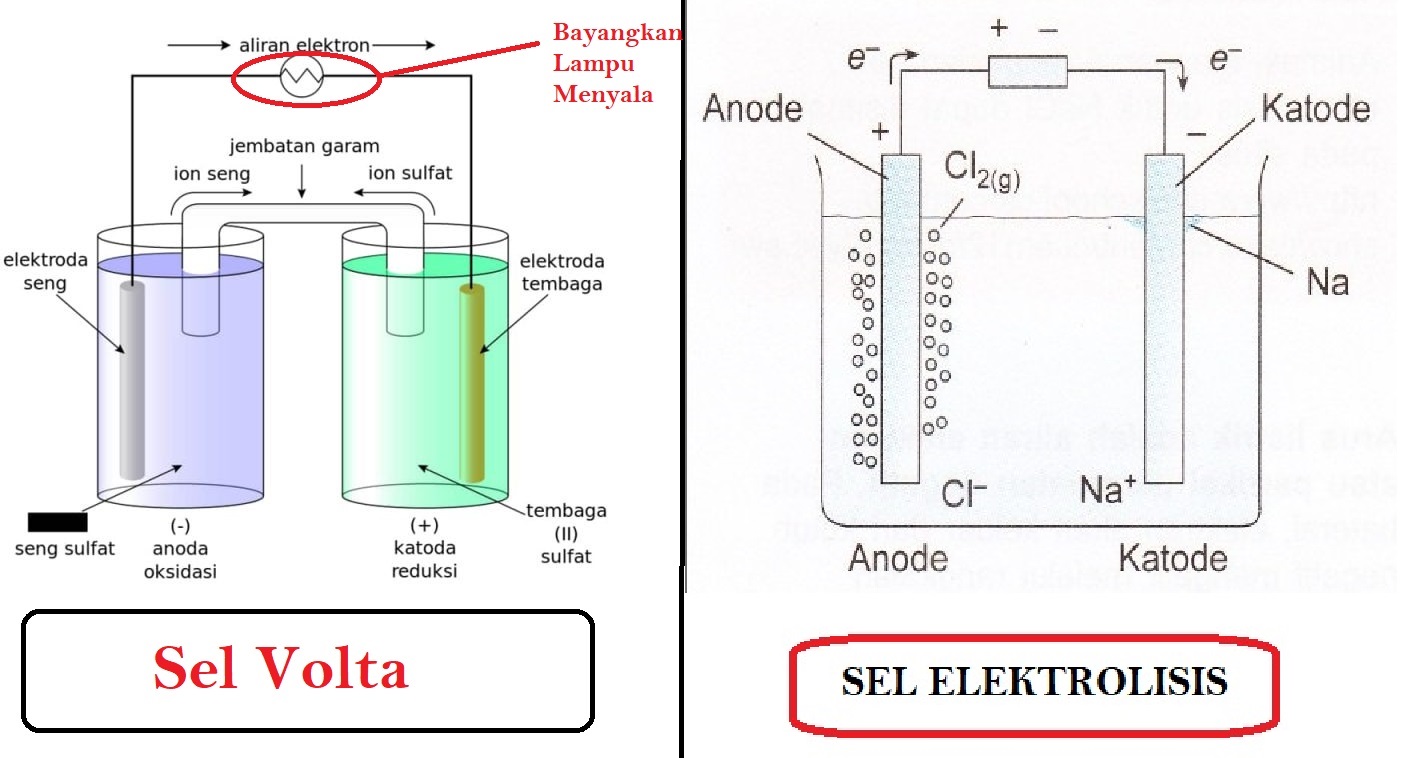
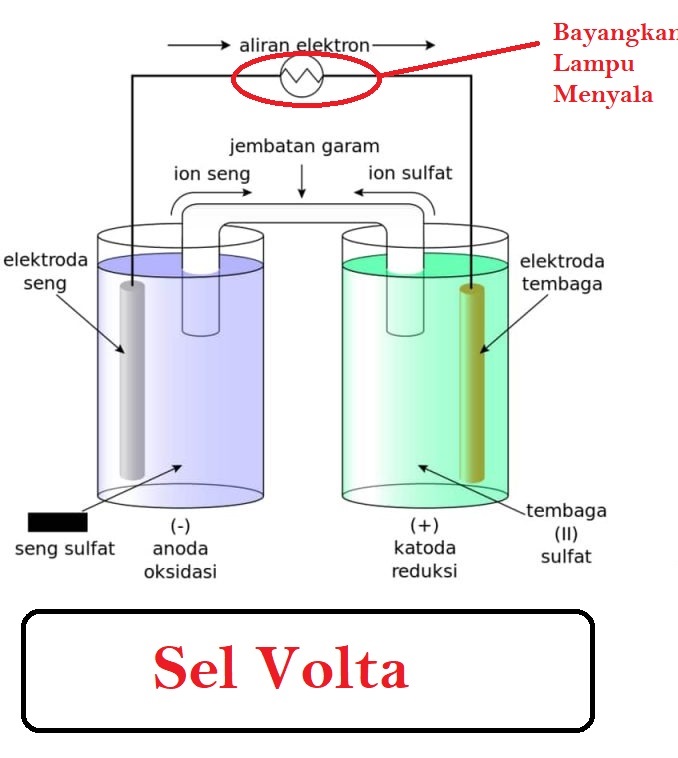
SEL VOLTA 1. Definisi Sel Volta Sel Volta adalah penataan bahan kimia dan penghantar listrik yang memberikan aliran elektron lewat rangkaian luar dari suatu zat kimia yang teroksidasi ke zat kimia yang direduksi. Dalam sel Volta, oksidasi berarti dilepaskannya elektron oleh atom, molekul, atau ion.
Kelas XII (KIMIA) Elektrokimia Konsep Dan Sel Volta (Part 1) Kirius Ilmu
KESIMPULAN 1. Sel volta merupakan suatu sel elektrokimia yang mengubah zat kimia menjadi energi listrik 2. Katoda (+) tempat terjadinya reduksi sedangkan anoda (-) tempat terjadinya oksidasi 3. Reaksi redoks dapat berlangsung secara spontan jika potensial sel lebih dari 0 4. Perbandingan antara buku dengan data hasil praktikum berbeda, hal ini.

Pembahasan Soal Sel Volta Kimia Kelas 12 Part 2 YouTube
Download Modul "Sel Volta" untuk Materi yang Lebih Lengkap dan Contoh Soal yang Lebih Banyak Di Sini. Pada gambar di atas, terlihat rangkaian sel volta dengan dua kompartemen. Masing-masing kompartemen merupakan setengah sel. Pada kompartemen kiri, dalam larutan ZnSO 4 terjadi setengah reaksi oksidasi Zn menjadi ion Zn 2+, sedangkan pada kompartemen kanan, dalam larutan CuSO 4 terjadi.

Animasi Sel Volta YouTube
Kesimpulan Berdasarkan percobaan yang kami lakukan maka dapat disimpulkan bahwa potensial sel pada sel volta, yaitu : LARUTAN 1 LARUTAN 2 E0Sel NO 1 ZnSO4 CuSO4 1,1 Volt 2 MgSO4 CuSO4 1,9 Volt 3 MgSO4 ZnSO4 0,9 Volt Adapun perbedaan potensial selnya pada percobaan dan teori terjadi karena konsentrasi larutan yang kurang tepat dan elektroda yang.

Sel Volta KIMIA KELAS 12 YouTube
Kesimpulan. Sel volta adalah jenis sel elektrokimia yang menghasilkan listrik melalui reaksi redoks spontan. Dalam sel volta, elektroda anoda mengalami reaksi oksidasi, menghasilkan elektron dan ion positif, sedangkan elektroda katoda mengalami reaksi reduksi yang melibatkan elektron dan ion positif. Kelebihan sel volta meliputi portabilitas.

CHANNEL EDUCATION SEL ELEKTROKIMIA
Pengertian Sel Volta. Kegunaan Sel Volta. Prinsip Sel Volta. Cara Kerja Sel Volta. Perbedaan Sel Volta dengan Sel Elektrolisis. Kesimpulan Pembahasan. Sebuah sel volta, sering dikenal sebagai sel galvanik, menyediakan energi listrik. Sumber energi ini adalah reaksi kimia spontan, lebih khusus lagi reaksi redoks spontan.
MATERI KIMIA KELAS XII BAB IV A.SEL VOLTA ATAU SEL GALVANI KOMPAS BELAJAR
Kesimpulan : Sel volta dibuat dari dua elektroda yang berbeda dalam larutan elektrolit dan dua elektroda yang dibungkan tersebut dapat menghasilkan listrik. Potensial sel yang dihasilkan oleh suatu electrode dengan electrode hydrogen disebut dengan. Link youtube: youtu/tMonk2QZVGE. AI Quiz.

Praktikum Sel Volta Sederhana (Baterai Buah) Membuat Sel Volta dari Jeruk Nipis YouTube
11 BAB III PENUTUP A. Kesimpulan 1. Susunan sel volta terdiri dari Anoda, Katoda, Jembatan Garam, dan elektrolit katoda dan anoda. 2. Cara kerja dari sel volta adalah yaitu pada kelebihan dan kekurangan elektron dinetralkan oleh jembatan garam yang memberikan ion positif dan negatif ke daerah yang membutuhkan. 3.

Soal Dan Pembahasan Sel Volta Ruang Ilmu
Kesimpulan. Sel volta adalah jenis sel elektrokimia yang menggunakan reaksi redoks untuk menghasilkan energi listrik. Proses sel volta melibatkan reaksi kimia antara logam dan elektrolit yang menghasilkan perbedaan potensial dan menghasilkan aliran arus listrik. Sel volta memiliki beberapa kelebihan yaitu mudah dalam pembuatan dan pengoperasian.

Materi Sel Volta Kimia Kelas 12 Bit CDN
Kesimpulan : Sel VOLTA 1. Sel VO LTA adal ah sel el ekt r oki m a i yang m i bat kan r eaksi r edoks dan el m enghasi l kan ar us l i st r i k. 2. Bagi an sel t em pat ber l angsungnya r eaksi r edoks di sebut el ekt r ode, ada 2: Anoda oksi dasi (el ekt r oda negat i f ) Kat oda r eduksi (el ekt r oda posi t i f ) 3.

Sel Volta Simple konsep & Contoh Soal YouTube
It's rare for a 1960s suburban development to exert a cultural pull distinct from its neighboring city, but Reston pulled it off. Situated about 20 miles from Washington, D.C., in what used to.

Diagram sel Volta, Potensial Sel,dan Reaksi Sel (ELEKTROKIMIA) KIMIA SMA YouTube
Celebrating Excellence: ZUL's Academic Awards Program Returns in 2024. 12 0. 2. Welcome to the website of the Zeta Upsilon Lambda Chapter of Alpha Phi Alpha Fraternity, Inc. The chapter was chartered on December 12, 1975, and proudly serves the Fairfax and Loudoun Counties communities Washington, D.C. Metropolitan Area.

Soal Dan Pembahasan Materi Sel Volta Dan Perkaratan Beserta Pembahasannya Materi Soal
Sel elektrokimia dapat dibagi menjadi : 1. Sel Volta / Sel Galvani merubah energi kimia menjadi listrik Contoh : batere (sel kering) dan accu 2. Sel Elektrolisis à merubah energi listrik menjadi energi kimia Contoh : penyepuhan, pemurnian logam Dalam sel volta, reasi redoks spontan digunakan sebagai sumber arus listrik.