Materi Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Kenaikan titik didih merupakan sifat koligatif larutan non elektrolit. Zat terlarut dalam larutan menghalangi gerakan molekul-molekul pelarut sehingga sehingga sukar lepas dari fase cair menjadi gas. Kenaikan titik didih bergantung pada kemolalan larutan. Makin tinggi kemolalan, zat terlarut makin banyak sehingga titik didih makin tinggi.

SIFAT KOLIGATIF LARUTAN KENAIKAN TITIK DIDIH YouTube
Kenaikan titik didih adalah salah satu dari empat sifat koligatif larutan, yaitu sifat larutan yang dipengaruhi oleh partikel zat pelarut. Kenaikan titik didih larutan adalah peristiwa di mana titik didih suatu larutan akan lebih tinggi daripada pelarut murninya. Misalnya, air memiliki titik didih 100 derajat celcius.

Melihat Proses Kenaikan Titik Didih Kimia Kelas 12 Belajar Gratis di Rumah Kapan Pun! Blog
Kenaikan titik didih adalah sifat koligatif, yang berarti bahwa kenaikan titik didih bergantung pada keberadaan partikel terlarut dan jumlahnya, tetapi tidak pada jenis zat tersebut.. D. Faktor-faktor yang mempengaruhi Titik Didih. 1. Konsentrasi ( molal ) zat terlarut mempengaruhi kenaikan titik didih, dimana semakin besar konsentrasi.
Cara Menentukan atau Menghitung Kenaikan Titik Didih Larutan SERBA SERBI
ΔTb = m × Kb. Titik didih larutan = 100 °C + 5,2 °C = 105,2 °C. Titik beku larutan = 0 °C - 18,6 °C = -18,6 °C. 2. Titik beku larutan 64 gram naftalena dalam 100 gram benzena adalah 2,91 °C. Jika titik beku benzena 5,46°C dan tetapan titik beku molal benzena 5,1 °C, maka. tentukan massa molekul relatif naftalena! 3.

Video Belajar Soal Kenaikan Titik Didih Pada Larutan Elektrolit Kimia My XXX Hot Girl
Kenaikan titik didih adalah fenomena yang terjadi untuk semua zat terlarut dalam semua larutan, bahkan dalam larutan ideal, dan tidak bergantung pada interaksi zat terlarut-pelarut tertentu. Peningkatan titik didih terjadi baik ketika zat terlarut adalah suatu elektrolit , seperti berbagai garam, dan nonelektrolit.

Kumpulan Contoh Soal Kenaikan Titik Didih Kimia Kelas 12 CoLearn halaman 17
Gelembung-gelembung air pada keseluruhan zat cair tersebut menandakan bahwa seluruh zat cair mengalami penguapan. Peristiwa saat keseluruhan zat cair menguap ini lah yang disebut proses mendidih.. Kb : Tetapan kenaikan titik didih molal (°C) atau konstanta ebulioskopi, yaitu kenaikan titik didih untuk 1 mol zat dalam 1000 gram pelarut; n :.

Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih YouTube
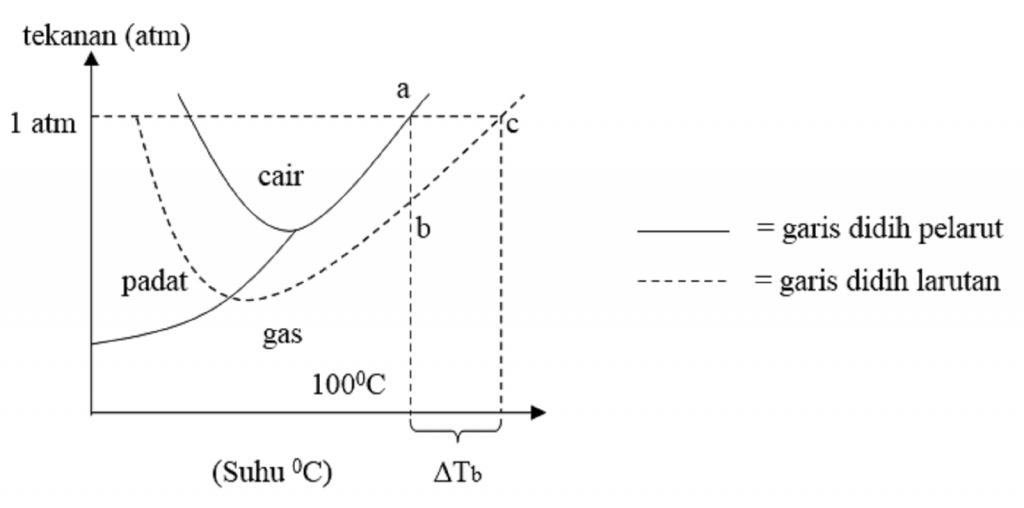
Kenaikan Titik Didih dan Penurunan Titik Beku Untuk memahami konsep kenaikan titik didih larutan kita akan contoh dalam kehidupan sehari-hari yakni apabila ke dalam air dilarutkan suatu zat tertentu, seperti yang kita ketahui akan terjadi penurunan tekanan uap larutan, sehingga pada suhu $\mbox{100}^{\circ}\mbox{C}$ larutan air belum mendidih.

Kenaikan Titik Didih LKS 1 PDF
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Tetapan kenaikan titik d.

Pengertian Titik Didih Larutan Dalam Ilmu Kimia LABORATORIUM SMK
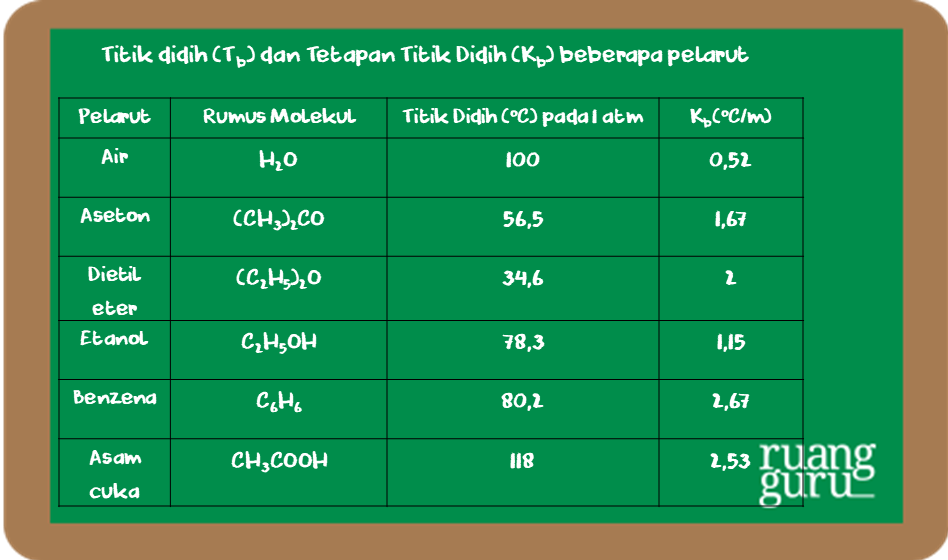
Kb = kenaikan titik didih molal (oC/m) yang bergantung pada pelarut Kb adalah konstanta kenaikan titik didih molal dan m adalah molalitas larutan. Satuan Kb. A-B-E. Jadi titik beku air tidak bergantung pada tekanan disekitarnya, melainkan bergantung pada tekanan uap padatnya. Pada diagram fasa (P-T), gambar 1.4

Tetapan kenaikan titik didih molal (Kb) tergantung pada.
T b° = titik didih pelarut murni (air) T b = titik didih larutan. Kenaikan titik didih hanya tergantung pada jenis pelarut dan molaritas larutan, tidak tergantung pada jenis zat terlarut. Jika ditambahkan zat terlarut yang tidak mudah menguap, misalnya gula, maka dibutuhkan kenaikan titik didih yang cukup besar agar dapat mendidih.

Kumpulan Contoh Soal Kenaikan Titik Didih Kimia Kelas 12 CoLearn halaman 16
Sifat koligatif sendiri hanya memandang "kuantitas", bukan "kualitas". Oleh sebab itu, sifat larutan, seperti rasa, warna, dan kekentalan (viskositas) merupakan sifat-sifat yang bergantung pada jenis zat terlarut yang tercampur dalam larutan. Terdapat empat sifat koligatif larutan, yaitu penurunan tekanan upa, kenaikan titik didih.

Materi Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Meskipun sifat koligatif melibatkan larutan, sifat koligatif tidak bergantung pada interaksi antara molekul pelarut dan zat terlarut, tetapi bergatung pada jumlah zat terlarut yang larut pada suatu larutan. [3] Sifat koligatif terdiri dari penurunan tekanan uap, kenaikan titik didih, penurunan titik beku, dan tekanan osmotik.
Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
Tb = 100 + 0,6656 = 100,6656 °C. Contoh soal 6 (UN 2019) Perhatikan percobaan pengukuran titik didih gula (glukosa) dan garam dapur (NaCl) berikut. Contoh soal 6. Jika Mr NaCl = 58,5 dan Mr glukosa = 180 dan Tb air = 100 C, tetapan kenaikan titik didih molal air dalam larutan glukosa dan NaCl adalah…. A. 0,52 °C/m.

Kenaikan Titik Didih (ΔTb) ilmu kimia
Kenaikan titik didih hanya bergantung pada jenis pelarut dan molaritas larutan, bukan pada jenis zat terlarut.. Tentukan kenaikan titik didih larutan gula 0,2 molal jika K B air = 0,52 °C molal-1. Diskusi. 0,2 larutan gula molal: ΔT B = K B. M = 0,52 °C molal-1 x 0,2 mol = 0,104 °C.

Cara Menghitung Kenaikan Titik Didih Pada Larutan Elektrolit Reverasite
ini kita akan membahas mengenai tetapan kenaikan titik didih molal atau KB di mana pertanyaannya adalah tetapan kenaikan titik didih molal atau KB bergantung pada titik didih pelarut B molalitas larutan C jenis pelarut molaritas larutan perbedaan titik beku dan titik didih larutan diketahui jika kita menggunakan dua jenis pelarut yang berbeda maka nilai KB nya akan berbeda pula misalnya di.

Sifat Koligatif Larutan Part 1 Penurunan Tekanan Uap dan Kenaikan Titik Didih YouTube
Selisih antara titik didih larutan dengan titik didih pelarut inilah yang disebut dengan kenaikan titik didih ( ∆T b ). Rumus untuk menentukan kenaikan titik didih ( ∆T b ) adalah: Untuk larutan yang bersifat elektrolit, maka persamaannya akan berubah menjadi: T b = K b . m [ 1 + ( n - 1 ) α ]