
Rumus Kimia Kalium Karbonat Dan Natrium Oksida
Tindak balas dengan Karbon dioksida. Pada suhu yang tinggi, kalium menukarkan karbon dioksida menjadi karbon monoksida dan karbon. Kegunaan. Terdapat pelbagai kegunaan untuk unsur ini. Kegunaannya adalah untuk: Baja: Dari sebatian kalium yang dihasilkan secara komersial hampir 95 peratus daripadanya digunakan dalam pertanian sebagai baja.

Kalium 396 mg, 100 tabletter Min Hälsobutik
Gas karbon dioksida dengan larutan kalium hidroksida membentuk larutan kalium karbonat dan air. Kita akan coba bahas pertahap : ⇒ karbon oksida : CO 2 ⇒ kalium hidroksida : K + + OH-→ KOH ⇒ kalium karbonat : K + + CO 3 2-→ K 2 CO 3 ⇒ air = H 2 O Maka persamaan reaksinya adalah :

Kalium jod. D6, dråber Allergica
Misalnya senyawa karbon dioksida (CO2) jika bereaksi dengan air akan bertindak sebagai asam dan membentuk larutan asam karbonat (H2CO3).. (Na2O), magnesium oksida (MgO), kalium peroksida (CaO2), kalsium oksida (K2O), dan barium oksida (BaO). Oksida Amfoter;
Comprar Kalium 312 Mg /Ml 150Ml Solucion Walmart Costa Rica
Studi Derivatigraphic kalium biftalate. Pengukuran derivatologis menunjukkan bahwa dekomposisi kalium biphthalate dimulai antara 190 ° C dan 200 ° C, dan sediaan non-higroskopis dapat disiapkan antara 100 ° C dan 150 ° C. Dekomposisi berlangsung dalam tiga langkah, yang kecepatannya tergantung pada laju kenaikan suhu: dipotassium phthalate.

Medikationsmanagement Kalium aus dem Gleichgewicht
Pembahasan. Kalium oksida terdiri dari kation kalium dan anion oksida. Muatan kation kalium yaitu +1 (karena kalium logam golongan IA) sedangkan muatan untuk anion oksida yaitu -2. Jika keduanya membentuk senyawaan, maka rumus kimianya dapat mengikuti konsep reaksi berikut: Jadi, rumus kimia senyawa kalium oksida yaitu K2O.

Gas karbon dioksida dengan larutan kalium hidroksi...
Agen pengoksida ialah bahan yang mengoksida bahan lain. Sebaliknya, sebatian yang dioksidakan ialah agen penurunan. Agen penurunan menurunkan sesuatu bahan yang lain. Dalam tindak balas ini, ferum (III) oksida diturunkan. Oleh itu ia adalah agen pengoksida. Ia telah mengoksidakan karbon monoksida kepada karbon dioksida. Karbon monoksida telah.
Kalium Healthiness
Hidrogen Peroksida + Kalium Permanganat = Mangan Dioksida + Kalium Hidroksida + Dioxygen. Struktur kimia. Reaktan. Hidrogen Peroksida - H 2 O 2. Glyroxyl. H2O2 Jisim Molar H2O2 Oxidation Number. Kalium Permanganat - KMnO 4. KMnO4 Jisim Molar KMnO4 Oxidation Number. Produk. Mangan Dioksida - MnO 2.
Vitaking Kálium 99mg (100 db) a normál vérnyomás fenntartásához
Oksida Oksida adalah senyawa kimia yang sedikitnya mengandung sebuah atom oksigen serta sedikitnya sebuah unsur lain. Contoh oksida: Sebagian besar kerak bumi terdiri atas oksida. Terbentuk ketika unsur-unsur dioksidasi oleh oksigen di udara. Pembakaran hidrokarbon menghasilkan dua oksida utama karbon, karbon monoksida, dan karbon dioksida.

SOLVED bagaimana ya ini? ada yang tau kah? Perhatikan tabel berikut! Simbol Bahan Contoh Bahan
Kalium oksida bereaksi keras dengan air, membentuk potasium hidroksida. 3. reaksi kalium oksida dengan karbon dioksida (gas asam karbonat): K2O + CO2 → К2СО3. Kalium oksida di udara bereaksi dengan karbon dioksida (yang merupakan oksida asam), membentuk garam dengan kalium karbonat. 4. reaksi kalium oksida dengan sulfur dioksida:

Kalium (Potasio en solución) — INFARMA
Kalium + Air → Natrium dioksida + Gas Hidrogen. Persamaan bersimbol. 2K + 2H 2 O → 2NaOH + H 2. Persamaan Kimia yang Seimbang Hukum keabadian jisim menyatakan bahawa atom-atom tidak boleh dimusnahkan atau dicipta dalam satu tindak balas kimia. Oleh itu bilangan atom setiap unsur sebelum dan selepas tindak balas mestilah sama.

Kalium Helhetshälsa Aroniabutiken
1. Industri Kaca: Kalium oksida digunakan dalam industri kaca untuk meningkatkan kekuatan dan kejernihan kaca. Senyawa ini juga membantu mengurangi titik leleh kaca dan meningkatkan kemampuan kaca untuk menyerap radiasi inframerah. 2. Pupuk: Kalium oksida adalah bahan penting dalam pembuatan pupuk. Senyawa ini memberikan kalium yang diperlukan.

Persamaan reaksi dari kalsium hidroksida + asam klorida menghasilkan kalsium klorida dan air
Kation lain. litium oksida. natrium oksida. rubidium oksida. sesium oksida. Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). Rujukan kotak info. Kalium oksida ialah sejenis kimia tidak organik yang dibuat dari oksigen dan kalium .
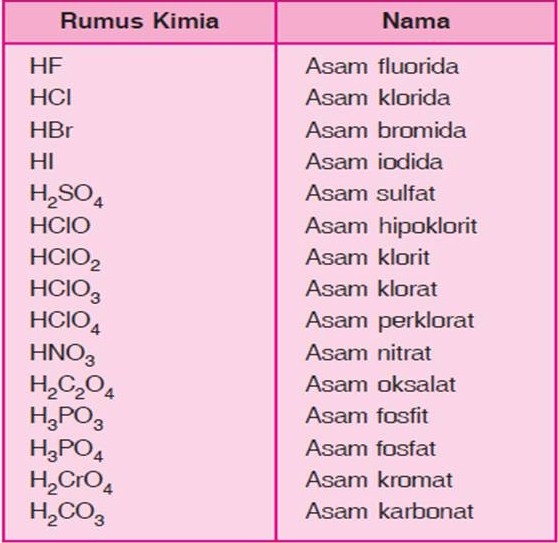
Nama Senyawa Hbr
Kalium dioksida. Nama lain Kalium superoksida. Penanda. Kalium superoksida digunakan sebagai CO 2 penggosok, H 2 O dehumidifier dan O 2 generator di rebreathers, pesawat ruang angkasa, kapal selam dan sistem pendukung kehidupan pakaian luar angkasa. Referensi Halaman ini terakhir diubah pada 11 Desember 2023, pukul 07.10..

Asam pikrat TNT Kalium nitrat Karbon dioksida Senyawa organik, 3d, ledakan, 3d png PNGEgg
Senyawa ini bereaksi dengan nitrogen dioksida untuk membentuk nitrat dan kalium nitrit pada suhu antara 150 dan 200 ° C: K 2 O + 2NO 2 = KNO 2 + KNO 3. Kalium oksida bereaksi pada suhu rendah dengan amonia untuk membentuk amida dan kalium hidroksida sesuai dengan reaksi: K 2 O + NH 3 (l) → KNH 2 ↓ + KOH (-50 ° C). Reaktivitas dan bahaya

Kalium 200 mg GPH Kapseln HECHT Pharma GmbH
Kalium dikromat, K 2 Cr 2 O 7,. Uji sulfur dioksida. Kertas kalium dikromat dapat digunakan untuk menguji sulfur dioksida, saat ia berubah khas dari jingga menjadi hijau. Hal ini khas dari semua reaksi redoks di mana kromium heksavalensi direduksi menjadi kromium trivalen. Oleh karena itu, hal ini bukan merupakan uji konklusif untuk sulfur.

FileElectron shell de 019 Kalium.svg Wikimedia Commons
Kalium hidroksida adalah suatu senyawa anorganik dengan rumus kimia K OH, dan umumnya disebut sebagai potash kaustik. Bersama dengan natrium hidroksida (NaOH), padatan tak berwarna ini adalah suatu basa kuat. Senyawa ini memiliki banyak aplikasi industri dan niche, sebagian besar yang memanfaatkan sifat korosif dan reaktivitasnya terhadap asam.