
PPT Jenis Perubahan Entalpi PowerPoint Presentation, free download ID5404861
3.5 Menjelaskan jenis entalpi reaksi, Hukum Hess dan konsep energi ikatan 4.5 Membandingkan perubahan entalpi beberapa reaksi berdasarkan data hasil percobaan C. Deskripsi Singkat Materi Salam jumpa siswa sekalian, semoga kalian selalu sehat dan semangat dalam belajar.. Perubahan entalpi yang dibutuhkan atau dilepaskan pada penyubliman 1 mol.

Persamaan Termokimia dan Jenis Perubahan Entalpi Materi Kimia Kelas 11 YouTube
Oleh karena itu, penentuan perubahan entalpi (ΔH) juga ditukar pada kondisi standar dan dikenal dengan perubahan entalpi standar. Berdasarkan jenis reaksinya, perubahan entalpi standar dapat dibedakan sebagai berikut. Contents hide. 1 1. Perubahan Entalpi Pembentukan Standar (ΔH°f) 2 2. Perubahan Entalpi Penguraian Standar (ΔH°d)

Menghitung Entalpi Pembakaran Standar Berdasarkan Data Entalpi Pembentukan Standar (UN Kimia No
Materi dalam video ini bertujuan untuk memahami tentang macam - macam perubahan entalpi dalam reaksi termokimia. Dengan mempelajari konsep dasar dari macam -.

Jenisjenis Perubahan Entalpi Standar YouTube
Maka, perubahan entalpi pada kondisi ini adalah panas yang diserap atau dilepas melalui reaksi kimia atau perpindahan panas eksternal. Entalpi gas ideal, solid, dan liquid tidak tergantung pada tekanan.. memiliki beberapa jenis proses kerja yang memerlukan pengukuran nilai. Unjuk kerja dari mesin refrigerasi kompresi uap ditentukan oleh.

Jenis jenis entalpi
Perubahan entalpi standar dapat dibedakan menjadi 3, yaitu : Jenis perubahan entalpi standar Perubahan entalpi pembentukan standar ( ΔH f o) kalor yang dibutuhkan atau dilepas pada peristiwa pembentukan 1 mol senyawa dari unsur-unsur pembentukannya. Contoh : 1/2 N2(g) + 1/2 O 2 (g) -> NO(g) ΔH f o + ΔH f o = +90 kJ/mol

MACAM MACAM PERUBAHAN ENTALPI YouTube
Misalnya, katakan kita akan mencari entalpi reaksi untuk pembentukan air dari hidrogen dan oksigen: 2H 2 (Hydrogen) + O 2 (Oxygen) → 2H 2 O (Water). Dalam persamaan ini, H2 dan O2 adalah reaktan dan H2O adalah produk. Tentukan massa total reaktan. Selanjutnya, carilah massa reaktanmu.

JenisJenis Perubahan Entalpi Standar YouTube
Perubahan entalpi yang terjadi pada titik lebur ketika lelehan padat melebur disebut entalpi peleburan atau pelelehan (Enthalpy of Fusion), dilambangkan dengan simbol ∆H fus.Entalpi peleburan didefiniskan juga sebagai kalor atau entalpi yang dibutuhkan untuk melelehkan 1 mol padatan. Nilai ∆H fus selalu positif. Pada tekanan tetap nilai ∆H fus sebagai berikut.

PPT Jenis Perubahan Entalpi PowerPoint Presentation, free download ID5404861
Jenis Entalpi. Perubahan kimia dapat terjadi melalui beberapa hal seperti reaksi kimia, penguapan, pelarutan dan lain lain. Bahkan reaksi kimia pun juga terdiri dari beberapa jenis reaksi kimia yang berbeda. Dengan definisinya dimana entalpi terlibat dalam perubahan kimia, maka hal itu menyebabkan entalpi ini dapat terjadi dalam beberapa jenis.

Termokimia Part 3 Jenis jenis Perubahan Entalpi Reaksi YouTube
Jenis-jenis entalpi reaksi meliputi: 1. Entalpi Pembentukan (∆Hf) Ini adalah entalpi perubahan yang terjadi ketika satu mol senyawa terbentuk dari unsur-unsur pembentuknya dalam keadaan standar (misalnya, pada 25°C dan 1 atm). Contoh: Pembentukan air (H2O) dari unsur-unsurnya, hidrogen (H2) dan oksigen (O2).

Perubahan Entalpi Penguraian Standar Dan Contohnya Amat
JENIS-JENIS DAN PENENTUAN PERUBAHAN ELTALPI. Kompetensi Dasar. 3.5 Menjelaskan jenis entalpi reaksi, hukum Hess dan konsep energi ikatan . 4.5 Membandingkan perubahan entalpi beberapa reaksi berdasarkan data hasil percobaan. Indikator Pencapaian Kompetensi Dasar . 1. Menjelaskan jenis entalpi. 2. Menghitung ∆H reaksi berdasarkan percobaaan . 3.

JenisJenis Perubahan Entalpi Reaksi (Video Pembelajaran Kimia Kelas XI) YouTube
Jenis-jenis Perubahan Entalpi Standar a. Perubahan Entalpi Pembentukan Standar (ΔH f 0. Entalpi pembentukan standar adalah kalor yang diserap atau dilepas pada pembentukan satu mol zat dari unsur-unsurnya diukur pada suhu 25 0 C dan tekanan 1 atm. Contoh: C (S) + O 2(g) → CO 2(g) ∆H f o = -393,5 kJ. b.

Simpel Konsep Jenisjenis Perubahan Entalpi Standar YouTube
ΔH = perubahan entalpi reaksi, ΔH produk = entalpi hasil reaksi, ΔH reaktan = entalpi awal reaksi. Baca juga: Energi: Pengertian, Jenis, Satuan, Hukum Kekekalan Energi Dilansir Khan Academy, jika perubahan entalpi lebih besar dari nol atau bertanda positif maka reaksi tersebut melakukan penyerapan kalor dari lingkungan ke sistem.. Adapun jika nilai entalpi menunjukkan nilai dibawah nol atau.
PPT JENISJENIS PERUBAHAN ENTALPI PowerPoint Presentation, free download ID5730431
Jenis-jenis Perubahan Entalpi Jenis-jenis Perubahan Entalpi. Perubahan Entalpi Pembentukan Standar Perubahan entalpi yang terjadi pada pembentukan 1 mol senyawa dari unsur-unsurnya pada suhu dan tekanan standar (25 o C, 1 atm). Contoh: Perubahan Entalpi Penguraian Standar Perubahan entalpi yang terjadi pada penguraian 1 mol senyawa menjadi unsur-unsur penyusunnya pada keadaan standar.

Entalpi Penguraian Standar (Jenisjenis Entalpi) YouTube
Berikut adalah jenis-jenis entalpi yang sering digunakan dalam industri kimia: 1. Entalpi Pembentukan. Entalpi pembentukan (ΔHf) adalah besarnya kalor yang dibutuhkan atau dilepaskan dalam reaksi kimia untuk membentuk satu mol senyawa dari unsur-unsur pembentuknya pada keadaan standar (tekanan 1 atm dan suhu 25°C).

PPT Jenis Perubahan Entalpi PowerPoint Presentation, free download ID5404861
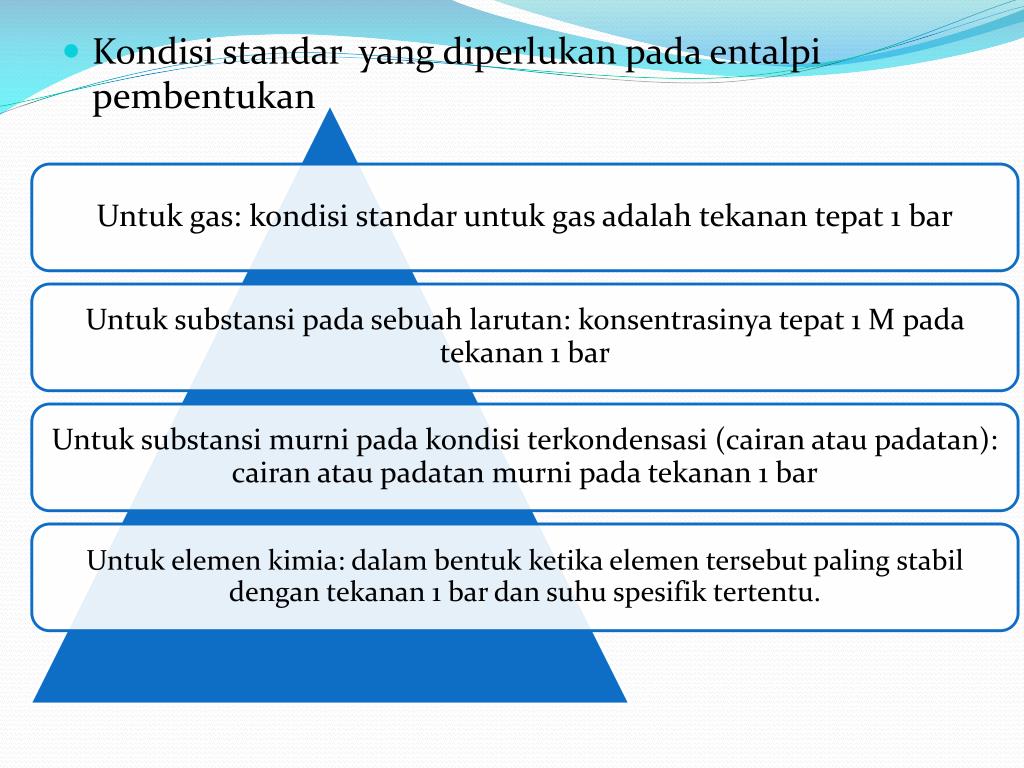
Entalpi standar (molar) adalah perubahan entalpi yang terjadi pada suhu 25° C (atau 298K), tekanan 1 atm, pada 1 mol suatu zat, dilambangkan dengan ΔH°. KOMPETENSI DASAR 3.3 Menjelaskan jenis entalpi reaksi, hukum Hess, dan konsep energi ikatan

Jenisjenis perubahan entalpi worksheet
1. Entalpi Pembentukan Standar ( ΔH ∘ f) Perubahan entalpi standar pada pembentukan 1 mol zat langsung dari unsur unsurnya pada keadaan standar (298 K, 1 atm). Sebagai contoh entalpi pembentukan standar untuk air adalah − 285 kJ/mol, maka persamaan termokimianya adalah sbb: H2(g) + 1 2O2 → H2O(l) ΔH = − 285 kJ.