
Hukum Faraday tentang GGL Induksi Induksi 1 YouTube
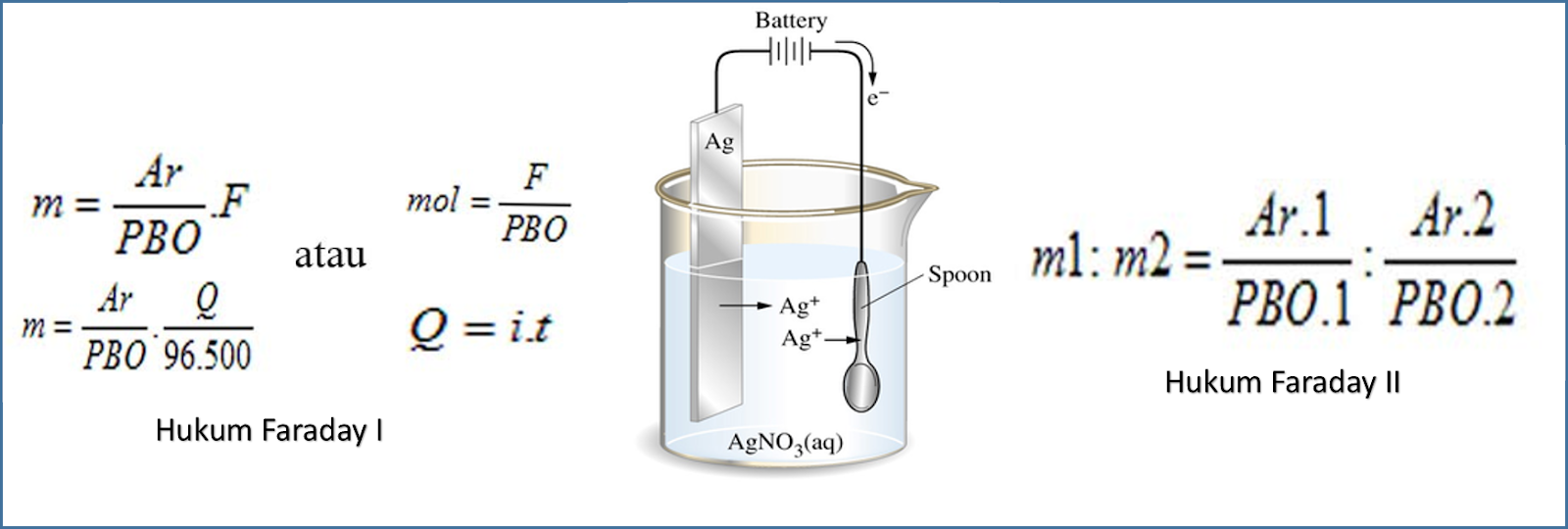
Hukum 1 Faraday. Hukum 1 Faraday berbunyi, "Massa zat yang dihasilkan oleh suatu elektrode selama elektrolisis(W) akan berbanding lurus dengan jumlah muatan listrik yang akan digunakan (Q)".Berikut ini merupakan persamaan untuk menyatakan Hukum 1 Faraday. W ~ Q. Jumlah muatan listrik yang digunakan (Q) sama dengan hasil kali antara kuat arus listrik (i) dan selang waktu (t).

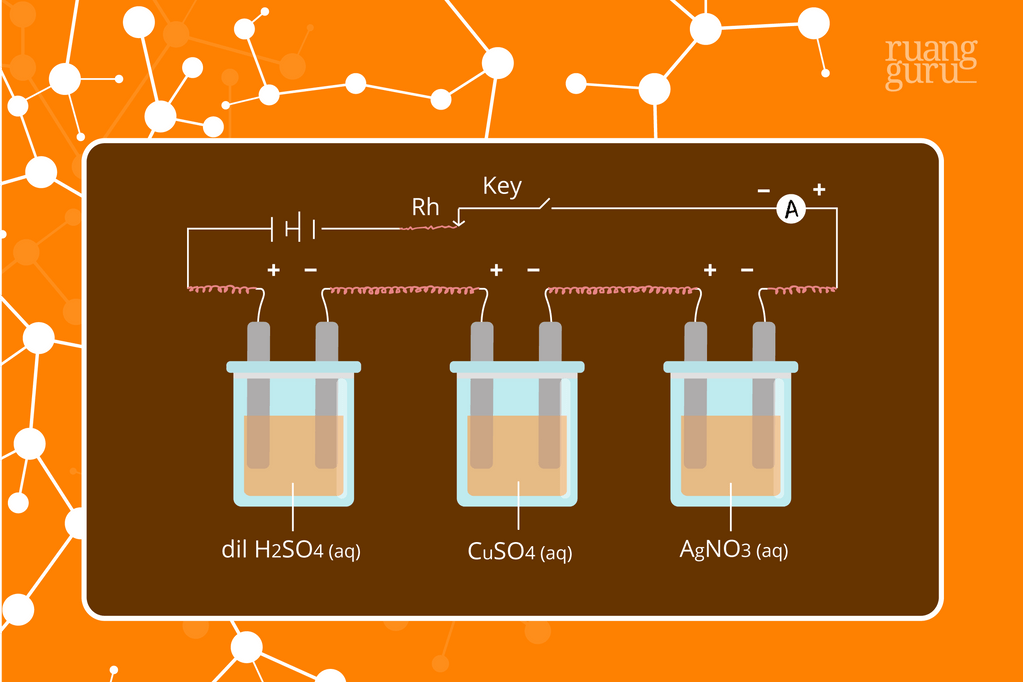
Foto Hukum Faraday I dan II tentang Elektrolisis
Hukum Faraday - PhET Interactive Simulations

Hukum 1 Faraday YouTube
Bunyi hukum Faraday 1 yaitu: "Massa zat yang diperoleh pada elektroda saat proses elektrolisis, sebanding dengan jumlah muatan listrik yang mengalir". Dari bunyi di atas, kita dapat melihat bahwa massa produk (W) yang diendapkan pada elektroda akan semakin banyak selama beriringan dengan peningkatan muatan listrik (Q) yang dipakai, maka W ≈ Q.

PERHITUNGAN SEL ELEKTROLISIS (HUKUM FARADAY 1) YouTube
Faraday merupakan orang Inggris yang pertama kali menerangkan hubungan antara banyaknya arus listrik yang digunakan pada elektrolisis dengan dengan hasil elektrolisisnya secara kuantitatif. Hukum Faraday dibagi menjadi dua, yaitu Hukum Faraday 1 dan 2. 1. Hukum I Faraday Hukum I Faraday berbunyi "Total zat yang dihasilkan pada elektroda, berbanding lurus dengan total muatan listrik yang

Hukum Faraday Definisi, Kegunaan dan Aplikasi Root of Science
Keterangan. W : Massa zat yang dihasilkan (gram) e : Massa ekuivalen. i : Kuat arus (ampere) t : Waktu (secon). F : Tetapan Faraday = 96.500 Coulomb/mol. 𝑄=𝑖×𝑡. Contoh soal penerapan Hukum Faraday 1 adalah sebagai berikut ini: 1.Tentukan Jumlah faraday untuk mereduksi ion Ca2+ dalam bentuk leburan (Ar Ca= 40) sebanyak 12 gram.
What is Faraday's Law? Laws of Induction
Contoh soal Hukum Faraday 1: 1. Dalam larutan elektrolisis Cu (NO3)2 dengan inert elektroda, 1,27 gram Cu (Ar, Cu = 63,5) diendapkan, volume gas yang dihasilkan di anoda pada 1 atm dan 0 ° C adalah.. karena elektron bergerak sama di katoda dan anoda, maka mole elektron di 4H+ adalah 0,04. 2.
Apa Bunyi Hukum Faraday 1 dan 2? Kimia Kelas 12
Learn about the relationship between electricity and magnetism in this interactive simulation. Build your own circuit with a battery, a light bulb, and a coil, and see how the coil reacts to a moving magnet. Experiment with different magnets and coils, and observe the induced current and voltage. This simulation is based on Faraday's law of electromagnetic induction.
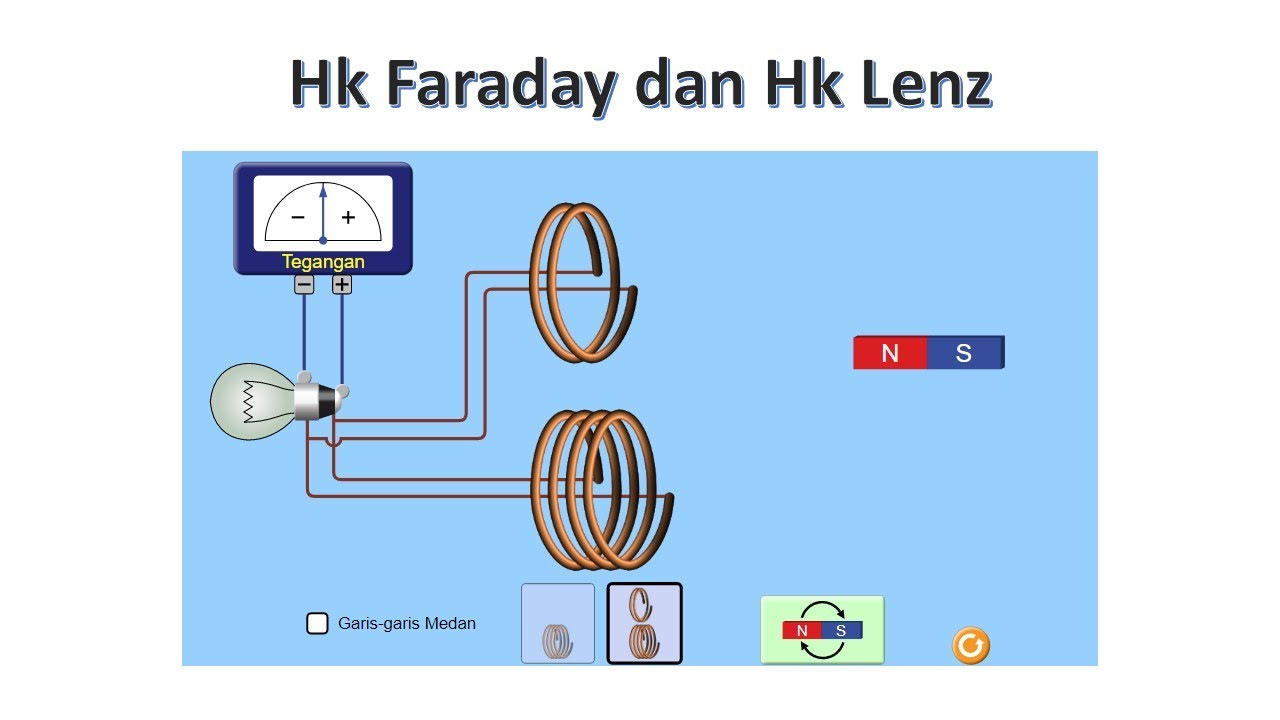
Hukum Faraday dan Hukum Lenz YouTube
Materi ini bertujuan untuk memahami perhitungan sel elektrolisis dengan menggunakan hukum Faraday 1. Dengan adanya contoh dan latihan soal di harapkan faham.

Faraday's law of induction vector illustration Electromotive force, induction
Adapun rumus hukum Faraday 1 dan 2 adalah sebagai berikut. Rumus Hukum Faraday 1. Ingat, bunyi hukum Faraday 1: "Massa zat yang dilepaskan selama elektrolisis berbanding lurus dengan jumlah listrik yang digunakan" Berdasarkan bunyinya, rumus hukum Faraday 1 dapat dituliskan sebagai berikut. G ≈ Q atau G ≈ it. Keterangan:
Hukum Faraday Pojok Kimia
Pengertian dan Bunyi hukum Faraday 1 dan 2☑️ Rumus (persamaan), Contoh Soal dan pembahasan hukum Faraday 1 dan 2 lengkap☑️ Seorang ilmuwan yang berasal dari Inggris bernama Michael Faraday menemukan sebuah hukum yang digunakan dalam ilmu kimia dinamakan Hukum Faraday. Hubungan antara penggunaan muatan listrik dan hasil massa zat dalam electrode dijelaskan melalui hukum ini.

Pembahasan Soal Elektrolisis Hukum Faraday 1 dan 2 YouTube
Contoh Soal Hukum Faraday. 1. Soal 1. Sumber dari gaya gerak listrik adalah.. a. magnet yang bergerak di sekitar kumparan. b. muatan listrik yang bergerak di sekitar kumparan. c. magnet yang diam di sekitar kumparan. d. dua buah magnet diam di sekitar kumparan. e. interaksi kutub-kutub magnet di sekitar kumparan.
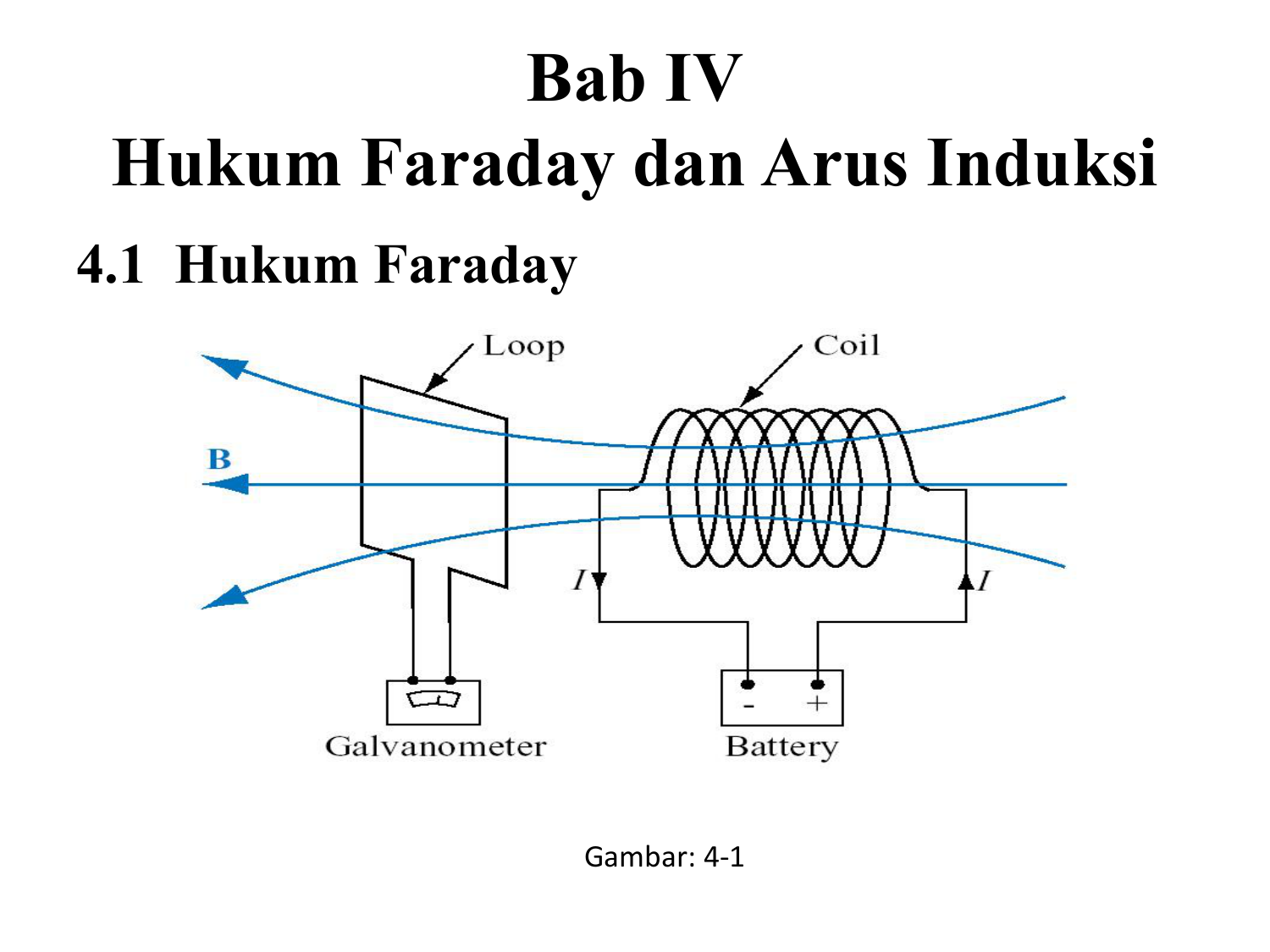
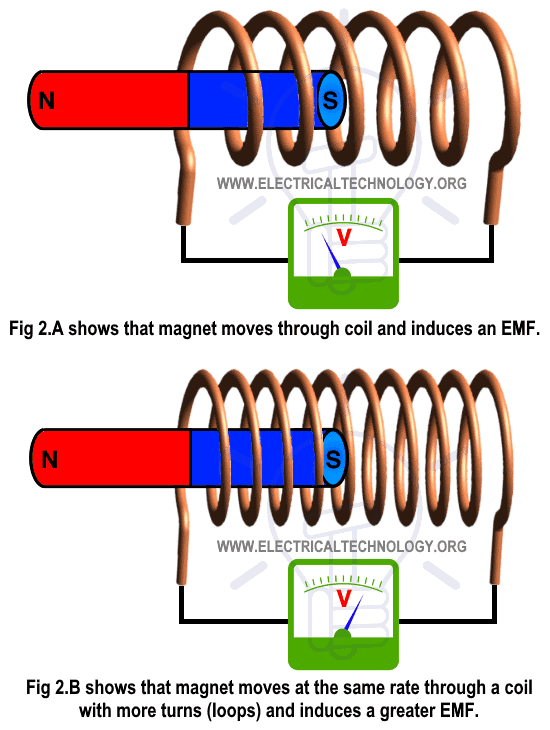
Hukum Faraday dan Arus Induksi
Jadi, Hukum Faraday 1 itu merupakan massa zat yang dihasilkan pada suatu electrode selama proses elektrolisis berbanding lurus dengan muatan listrik yang digunakan. Kita sudah mengetahui bahwa massa zat (w) yang dihasilkan pada elektrode berbanding lurus dengan jumlah molelektron. Sementara, jumlah mol elektron berbanding lurus dengan muatan.

Mengenal Bunyi Hukum Faraday Kimia Kelas 12
Hukum Faraday I. "Massa zat yang dihasilkan pada suatu elektrode selama elektrolisis (G) berbanding lurus dengan jumlah muatan listrik yang digunakan (Q).". Secara matematis, hukum Faraday I dapat ditulis dalam persamaan berikut. Sebagaimana jumlah muatan listrik (Q) sama dengan hasil kali dari kuat arus listrik (i) dengan selang waktu (t.

HUKUM FARADAY 1 & 2Contoh soal HUKUM FARADAY UTBKSBMPTN YouTube
Faraday's law of induction (or simply Faraday's law) is a law of electromagnetism predicting how a magnetic field will interact with an electric circuit to produce an electromotive force (emf). This phenomenon, known as electromagnetic induction, is the fundamental operating principle of transformers, inductors, and many types of electric.

Hukum Faraday Induksi Part 1 Fisika Dasar YouTube
Research. Initiatives. Inclusive Design. PhET Global. DEIB in STEM Ed. Donate. Investigate Faraday's law and how a changing magnetic flux can produce a flow of electricity!

Rumus Praktis Hukum Faraday Pojok Kimia
Bunyi Hukum Faraday 1 dan Hukum Faraday 2. Untuk Bunyi Hukum Faraday 1 berbunyi, " Massa Zat yg dibebaskan dan dihasilkan didalam Elektroda selama Elektrolisis berbanding lurus dengan Jumlah (Muatan) Listrik yang ditransfer pada Elektroda tersebut. Maka Jumlah Listrik tersebut adalah Muatan Listrik yang memiliki satuan Coulomb (C) ".