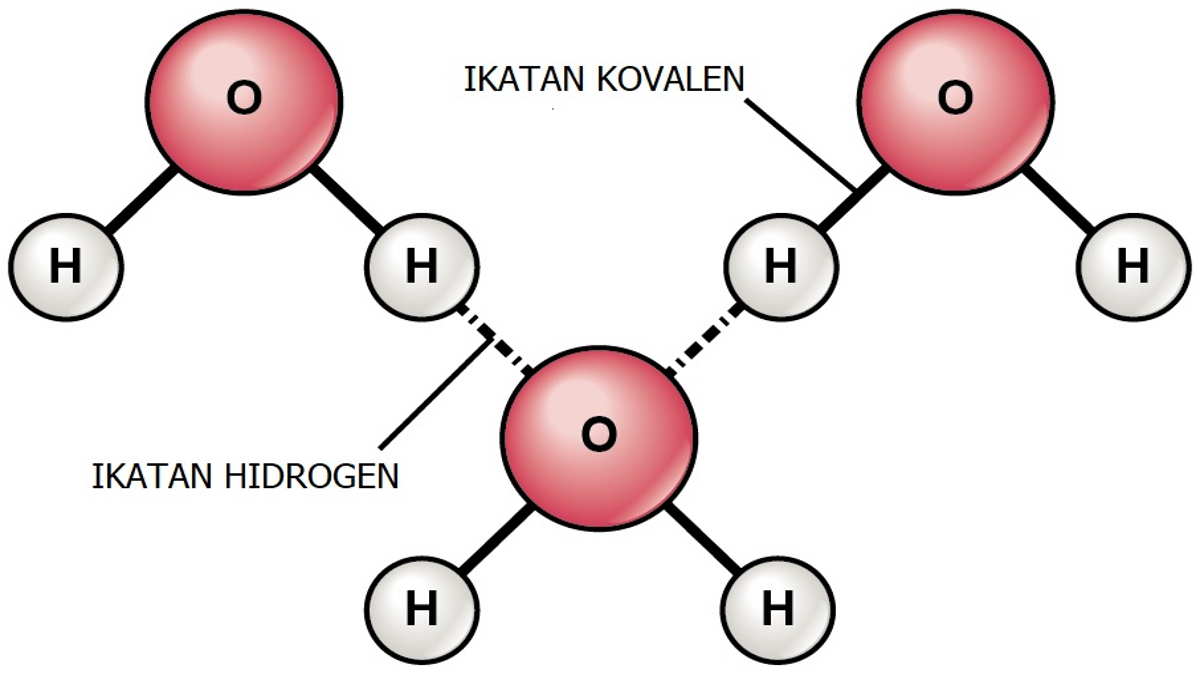
Contoh Ikatan Hidrogen dalam Kimia, Berikut Pengertiannya
25 Februari 2023. hidrogen yang berperan sebagai oksidator terdapat pada reaksi -. Hidrogen memiliki peran penting dalam reaksi oksidator. Hidrogen berperan sebagai oksidator dalam reaksi kimia dengan mereaksikan hidrogen dengan oksigen untuk membentuk air. Reaksi ini dikenal sebagai reaksi oksidasi-reduksi.

Reaksi Kimia Di Bawah Ini Yang Merupakan Reaksi Redoks Adalah Terbaru
Oleh sebab itu, HCl dinamakan sebagai oksidator. Contoh Reaksi Redoks. Salah satu contoh reaksi redoks yaitu antara hidrogen dan fluorin: H2 + F2 a 2 HF. Anda bisa menuliskan semua reaksi tersebut sebagai 2 (dua) reaksi setengah: Reaksi oksidasi: H2 a 2H+ + 2e-Reaksi reduksi: F2 + 2e- a 2F-

PPT Reaksi oksidasi reduksi PowerPoint Presentation, free download ID924292
Untuk mengetahui zat yang berperan sebagai reduktor dan oksidator, maka perlu ditentukan nilai biloks masing-masing unsur yang terlibat pada reaksi. Aturan penentuan biloks yang digunakan adalah sebagai berikut : Bilangan oksidasi atom unsur bebas adalah nol. Bilangan oksidasi hidrogen dalam senyawa = +1, dalam hidrida logam, bilangan oksidasi.

H2O2 bertindak sebagai oksidator terdapat pada reaksi...
Contoh Soal Reduktor dan Oksidator. 1. Tentukan reduktor dan oksidator, hasil oksidasi, dan hasil reduksi pada reaksi redoks berikut ini: 2KMnO4 + 5H2C2O4 + 3H2SO4 → K2SO4 + 2MnSO4 + 10CO2 + 8H2O. 2KMnO 4 + 5H 2 C 2 O 4 + 3H 2 SO 4 → K 2 SO 4 + 2MnSO 4 + 10CO 2 + 8H 2 O.

PPT Reaksi oksidasi reduksi PowerPoint Presentation, free download ID924292
3. Biloks unsur bebas = 0. 4. Jumlah biloks unsur pada senyawa netral = 0. Hidrogen yang berperan sebagai oksidator ada pada reaksi redoks dimana unsur H mengalami reaksi reduksi (penurunan bilangan oksidasi), yaitu pada reaksi nomor (3) dan (4). (3) H₂ + 2Na → 2NaH Unsur H mengalami penurunan biloks dari 0 pada H₂ menjadi -1 pada NaH.

Persamaan reaksi kimia yang merupakan reaksi pada uji kua...
Contoh soal ini ditujukan sebagai bahan belajar bagi para siswa di rumah. - Halaman all. Massa hidrogen yang terdapat pada 27 gram air (Ar H = 1; O = 16) adalah.. A. 3 gram. B. 6 gram. C. 7 gram.. oksidasi dengan suatu oksidator menghasilkan senyawa yang dapat memerahkan lakmus biru.

Reaksi Redoks , oksidator dan reduktor Kimia SMA YouTube
Pertama, dalam reaksi redoks, unsur-unsur bebas seperti Cl2 (klorin), Cu (tembaga), dan O2 (oksigen) sering terlibat. Unsur-unsur ini dapat berperan sebagai oksidator atau reduktor, tergantung pada kondisi reaksi. 2. Perubahan Biloks. Lalu, dalam reaksi redoks, terjadi perubahan bilangan oksidasi (biloks) pada unsur-unsur yang terlibat.

Konsep Reaksi Redoks
Hidrogen adalah bahan yang mudah terbakar dan dapat membentuk campuran peledak dengan oksigen atau gas lainnya. Oleh karena itu, pemanfaatan hidrogen sebagai oksidator harus dilakukan dengan hati-hati dan dengan mengikuti prosedur keamanan yang benar. Kesimpulan. Hidrogen adalah unsur kimia yang berperan sebagai oksidator dalam reaksi kimia.

Mempelajari Konsep Reaksi Redoks (ReduksiOksidasi) Kimia Kelas 10
Pengertian Reaksi Redoks. Redoks adalah istilah yang menjelaskan perubahan bilangan oksidasi dalam sebuah reaksi kimia. Nah, lebih lanjut, hal ini dapat berupa reaksi redoks sederhana seperti oksidasi karbon yang menghasilkan karbon dioksida (CO2), atau reduksi karbon oleh hidrogen sehingga menghasilkan metana (CH4), ataupun dapat berupa proses kompleks seperti oksidasi gula pada tubuh manusia.
senyawa mangan yang bertindak sebagai oksidator te...
A. zat yang teroksidasi B. zat hasil reduksi C. zat hasil oksidasi D. zat yang mengalami reduksi E. zat yang tereduksi 10. Diketahui reaksi-reaksi sebagai berikut : (1) H2 + S → H2S (2) H2 + N2 → NH3 (3) H2 + 2Na → 2 NaH (4) H2 + Li → LiH Hidrogen yang berperan sebagai oksidator terdapat pada reaksi. A.

MEKANISME REAKSI OKSIDASI SENYAWA ORGANIK (ALKOHOL)
Berdasarkan definisi Lewis, asam yang berperan sebagai spesi penerima pasangan elektron tidak hanya H +. Senyawa yang memiliki orbital kosong pada kulit valensi seperti BF 3 juga dapat berperan sebagai asam. Sebagai contoh, reaksi antara BF 3 dan NH 3 merupakan reaksi asam-basa, di mana BF 3 sebagai asam Lewis dan NH 3 sebagai basa Lewis.

Reaksi Oksidasi Senyawa Hidrokarbon MateriKimia
Oksidasi adalah reaksi yang mengalami kenaikan bilangan oksidasi. Oksidator adalah zat yang mengoksidasi zat lain dalam reaksi redoks atau zat yang mengalami reaksi reduksi. Contoh: Bilangan oksidasi adalah muatan positif dan negatif pada suatu atom. Unsur yang biloksnya positif, biasanya merupakan atom-atom unsur logam, seperti

Contoh Soal Reduksi Oksidasi
Selain menghasilkan oksigen, reaksi dekomposisi hidrogen peroksida juga menghasilkan air (H2O) dan panas. Reaksi dekomposisi eksotermis yang terjadi adalah sebagai berikut: H2O2 -> H2O + 1/2O2 + 23.45 kcal/mol. Faktor-faktor yang mempengaruhi reaksi dekomposisi hidrogen peroksida adalah: 1. Bahan organik tertentu, seperti alkohol dan bensin.

Konsep Mudah Menentukan Reduksi, Oksidasi, Reduktor dan Oksidator pada Reaksi Kimia SMA YouTube
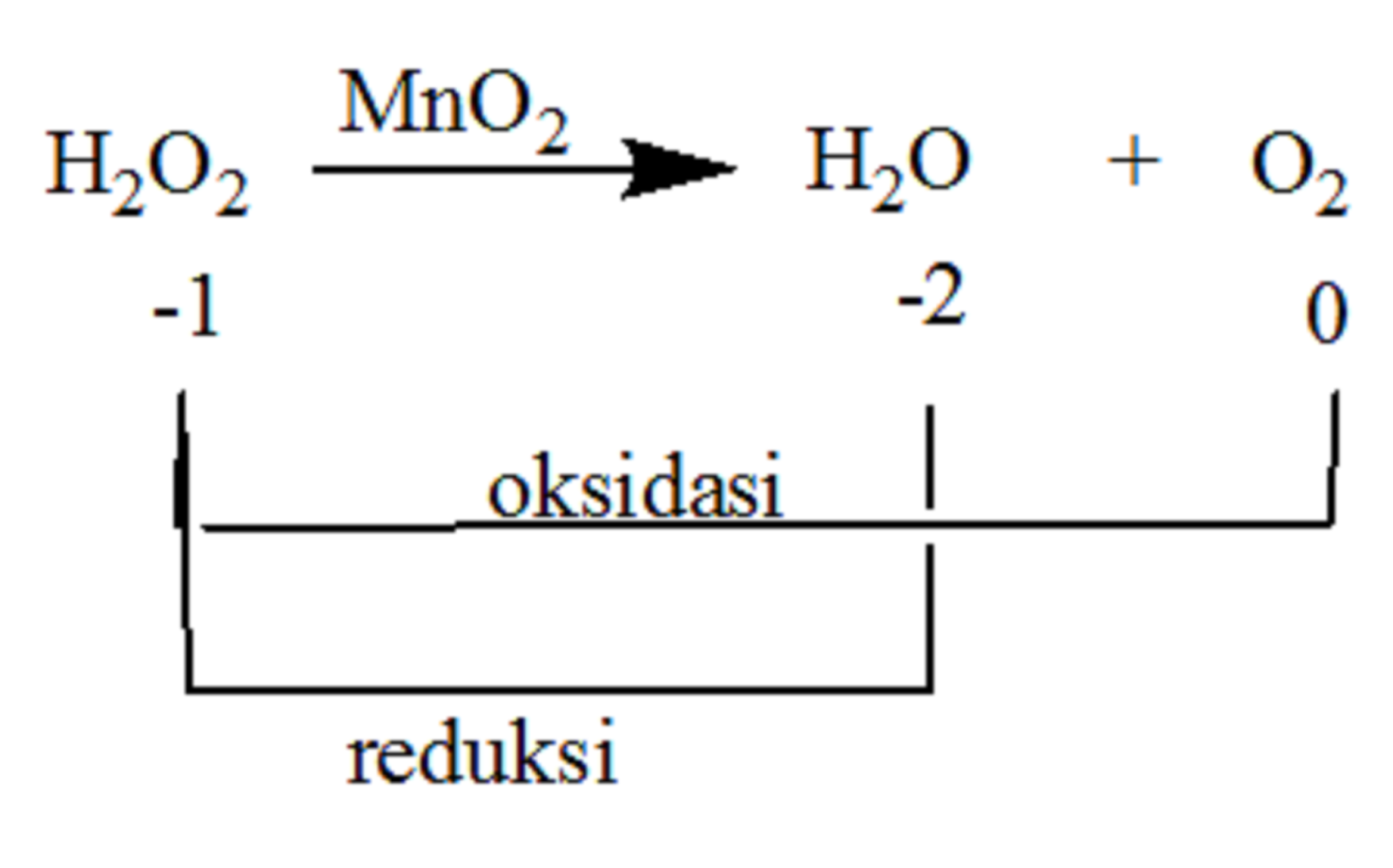
1. Berdasarkan penangkapan atau pelepasan oksigen. Oksidasi: reaksi yang melibatkan penangkapan atom oksigen. Contoh: C+ O2 → CO2. Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi CO2. Reduksi: reaksi yang melibatkan pelepasan atom oksigen. Contoh: H2O2 → H2O + O2.
PERCOBAAN VIII REAKSI REDOKS (Kimia Dasar II) Blog Najih
Pada reaksi reduksi dan oksidasi (redoks), ada beberapa unsur yang bertindak sebagai reduktor dan oksidator.. Senyawa yang berupa reduktor inilah yang terdapat pada unsur logam. Contohnya Lu, Na, Mg, Fe, Zn, dan Al.. Unsur-unsur bahkan dalam bentuk molekul ini kerap kali mempunyai bilangan oksidasi nol. Pada reaksi diatas hidrogen.

PPT Reaksi oksidasi reduksi PowerPoint Presentation, free download ID924292
Oke, kita lanjut ya bahasannya! Pada reaksi redoks, terdapat unsur-unsur yang bertindak sebagai reduktor dan oksidator. Zat yang mengalami oksidasi itu disebut reduktor, sedangkan zat yang mengalami reduksi disebut oksidator. Coba perhatikan contoh berikut ini, ya! Reaksi: Mg(s) + 2HCl -----> MgCl2(aq) + H2(g) Karena Mg merupakan unsur bebas, jadi biloks Mg = 0.