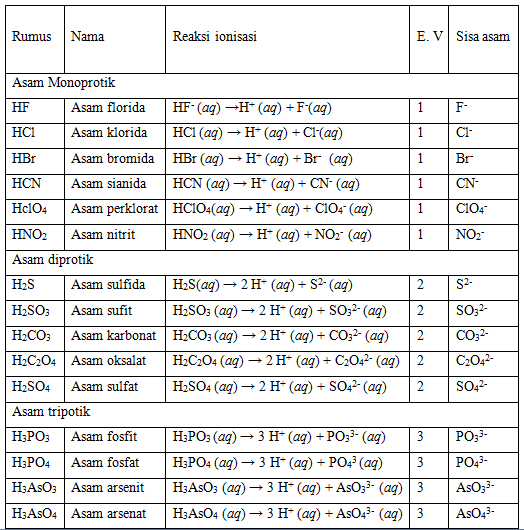
Teori Asam Basa Dan Garam Fisika Dan Matematika kulturaupice
Titrasi basa kuat oleh asam kuat, artinya: Titran (larutan standar pada buret) → asam kuat. Titrat (larutan sampel pada labu erlenmeyer) → basa kuat. Titrasi basa kuat oleh asam kuat akan menghasilkan kurva sebagai berikut. 3. Titrasi Asam Lemah oleh Basa Kuat.

Hidrolisis Garam Pengertian, Macam, Dan Rumus, Beserta Contoh Soalnya Secara Lengkap
Sedangkan garam netral adalah garam yang terbentuk dari reaksi asam kuat dengan basa kuat dan juga dari reaksi asam lemah dengan basa lemah. Sudah pahamkan? Untuk memperdalam pengetahuanmu, berikut materikimia berikan 10 contoh garam asam, garam basa, dan garam netral.

PERHITUNGAN pH ASAM LEMAH DAN BASA LEMAH YouTube
Sifat Asam dan Basa. Asam dan basa memiliki sifat yang berbeda. Sifat atau karakteristik asam dan basa dapat kamu lihat pada infografik berikut. Seperti yang tadi sudah dibahas, dari segi rasa, asam memiliki rasa yang masam sedangkan basa memiliki rasa yang pahit. Lalu, dari segi pH, asam memiliki pH di bawah 7, sedangkan basa memiliki pH di.

Mengenal Asam Basa Sifat, Cara Membedakan, dan Klasifikasinya Kimia Kelas 11
Contoh dari senyawa garam jenis ini adalah NH4Cl yang merupakan garam yang terbentuk dari asam kuat HCl dan basa lemah NH4OH. Asam Lemah - Basa Lemah. Ketika asam lemah dan basa lemah bereaksi, maka garam yang terbentuk akan mengalami hidrolisis total yang artinya seluruh senyawa garam dapat terurai dengan air.

Garam Lemah Ilmu
Oleh karena itu, larutan garam dari asam lemah dan basa kuat akan meningkatkan konsentrasi OH − dalam air sehingga larutannya bersifat basa (pH > 7).. Garam dari asam lemah dan basa lemah. Garam seperti CH 3 COONH 4 yang dapat terbentuk dari reaksi asam lemah (CH 3 COOH) dan basa lemah (NH 3) akan mengalami hidrolisis kation dan anionnya. pH larutan garam demikian bergantung pada kekuatan.

Cara Menghitung Ph Asam Lemah Satu Manfaat
Oleh karena itu garam dapat terbentuk dari 4 reaksi kimia sebagai berikut: 1. Garam dari asam kuat dan basa kuat, dimana garam ini akan memiliki pH = tujuh alias bersifat netral, yang artinya tidak terjadi hidrolisis. 2. Garam dari asam kuat dan basa lemah, garam akan memiliki pH < tujuh alias bersifat asam. 3.

Detail Contoh Asam Kuat Asam Lemah Basa Kuat Basa Lemah Koleksi Nomer 21
Garam dari basa kuat dan asam lemah, garam ini bersifat basa (pH >7). Contohnya adalah Na 2 SO 3, KCN, Na 2 CO 3, (CH 3 COO) 2 Ca. Garam dari asam lemah dan basa lemah, sifat asam/basa bergantung pada nilai Ka dan Kb dari senyawa tersebut. Contoh Zn(NO 2) 2, CH 3 COONH 4, Fe 3 (PO 4) 2. Pengertian Hidrolisis.

Contoh Asam Lemah Dan Basa Lemah Brain
Asam + basa → garam + air. HCl + KOH → KCl + H2O. Garam dapur (NaCl) diperoleh dari air laut yang mengalami penguapan dan kristalisasi. Untuk menjadikannya garam beryodium, harus diproses iodisasi (garam kalium/KI). Sifat-sifat atau ciri-ciri garam: Larut dalam air. Contohnya : KNO3, NH4Cl, Na2SO4. Sukar larut dalam air.
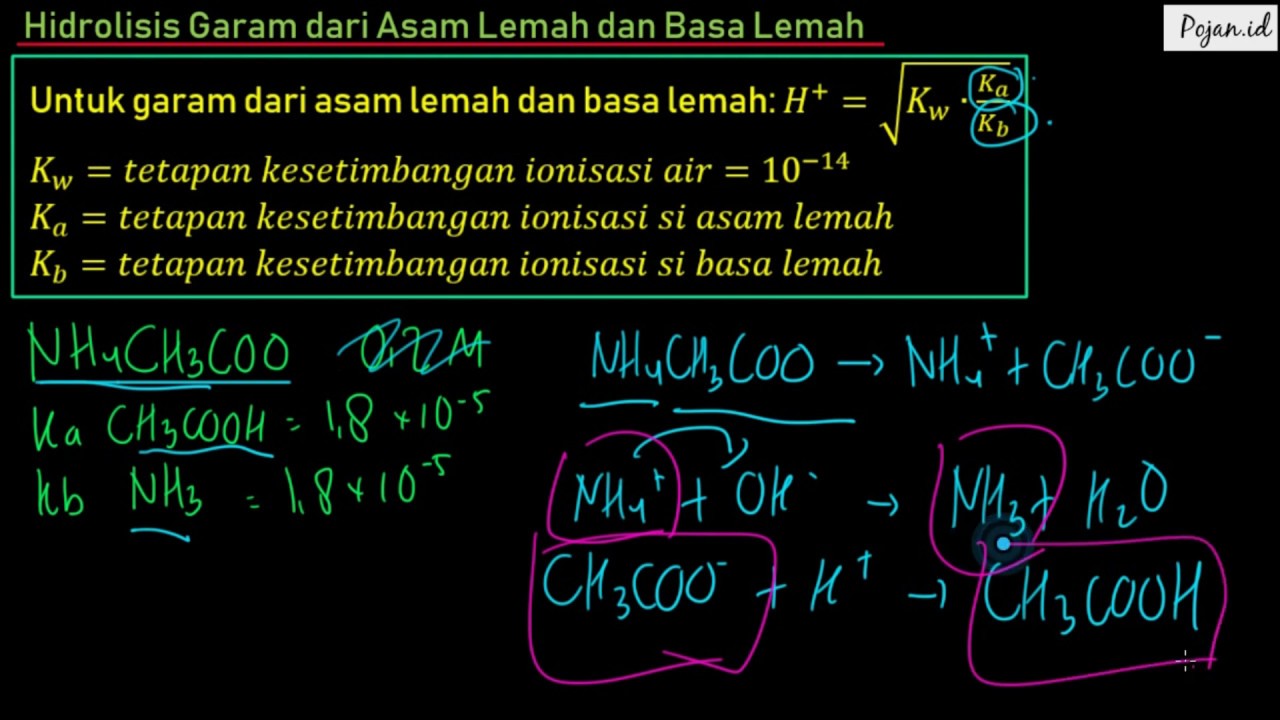
Hidrolisis Garam dari Asam Lemah dan Basa Lemah Materi Hidrolisis Garam Kimia SMA Pojan.id
3. Garam yang terbentuk dari komponen asam lemah dan basa lemah. Garam yang berasal dari asam lemah dan basa lemah dalam air akan mengalami hidrolisis total, karena kedua komponen garam (anion asam lemah dan kation basa lemah) terhidrolisis akan menghasilkan ion H + dan ion OH -, sehingga pH larutan ini bergantung pada nilai K a dan K b. Rumus :

20+ Contoh Soal Hidrolisis Asam Lemah Dan Basa Kuat Contoh Soal Terbaru
Garam yang berasal dari asam lemah dan basa lemah mengalami hidrolisis sempurna. Garam ini terionisasi dalam air menghasilkan ion-ion. Kation dan Anion keduanya berasal dari asam lemah dan basa lemah. Kedua ion tersebut mengalami hidrolisis sempurna. Garam yang termasuk jenis ini antara lain:CH 3 COONH 4, (NH 4) 2 CO 3.

Hidrolisis Garam dari Asam Kuat dan Basa Lemah Materi Hidrolisis Garam Kimia SMA Pojan.id
Kebalikan dari tetapan hidrolisis garam asam kuat dan basa lemah, hidrolisis asam lemah dan basa kuat bersifat basa (pH > 7). Maka rumus tetapan hidrolisis garamnya adalah sebagai berikut: A -(aq) + H 2 O (l) → HA (aq) + OH -(aq) Kh = [HA] x [OH -] : [A -] 4. Rumus tetapan hidrolisis garam yang berasal dari asam lemah dan basa lemah.

Hidrolisis Garam dari Asam lemah dan Basa Kuat Rumus Kimia
Garam dari asam lemah dan basa lemah terhidrolisis sempurna. Garam dari asam lemah dan basa lemah terhidrolisis secara sempurna dalam air karena kation dan airnnya berekasi dengan air. Hal ini sangat berkebalikan dengan garam yang terbuat dari asam kuat dan basa kuat yang tidak terhidrolisis sama sekali. Dilansir dari Chemistry LibreTexts.

pH Garam dari Asam Kuat dan Basa Lemah YouTube
Dalam kehidupan sehari-hari, asam basa dan garam memiliki fungsi yang sangat penting. Asam bisa dijumpai dalam larutan cuka dan vitamin C pada buah.. yaitu asam basa kuat dan asam basa lemah. Berikut ini penjelasannya:. Kamu bisa melihat dari ciri-ciri asam dan basa yang sudah disebutkan di atas. Selain itu, kamu juga dapat menggunakan.

PPT BAB 2 ASAM, BASA DAN GARAM PowerPoint Presentation, free download ID5075424
1. Proses hidrolisis menghasilkan asam dan basa pembentuk garam. 2. Kation dan anion dari asam-basa kuat tidak dapat terhidrolisis karena terionisasi sempurna. 3. Garam tidak terhidrolisis jika tidak ada kation maupun anion yang bereaksi. 4. Garam terhidrolisis sebagian jika salah satu kation atau anion bereaksi. 5.

Perhitungan pH Garam dari Asam lemah dan Basa Lemah
Oleh karena itu garam dapat terbentuk dari 4 reaksi hidrolisis kimia sebagai berikut: Garam yang berasal dari asam lemah dan basa kuat bersifat netral dan memiliki pH = 7, yang artinya tidak terjadi hidrolisis. Garam dari asam kuat dan basa lemah, di mana garam ini akan memiliki pH < 7 alias bersifat asam. Garam dari asam lemah dan basa kuat.

Contoh Asam Lemah Dan Basa Lemah Brain
2. Reaksi antara asam kuat dan basa lemah. Reaksi asam dan basa juga bisa terjadi pada larutan dengan asam kuat dan larutan dengan basa lemah. Contoh: HBr (aq) + NH 3(aq) → NH 4 Br (aq) Dari contoh di atas, dapat diketahui bahwa HBr adalah asam kuat, sedangkan NH3 adalah basa lemah. Hasil reaksi antara asam kuat dan basa lemah ini dapat.