Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11 Belajar Gratis di Rumah
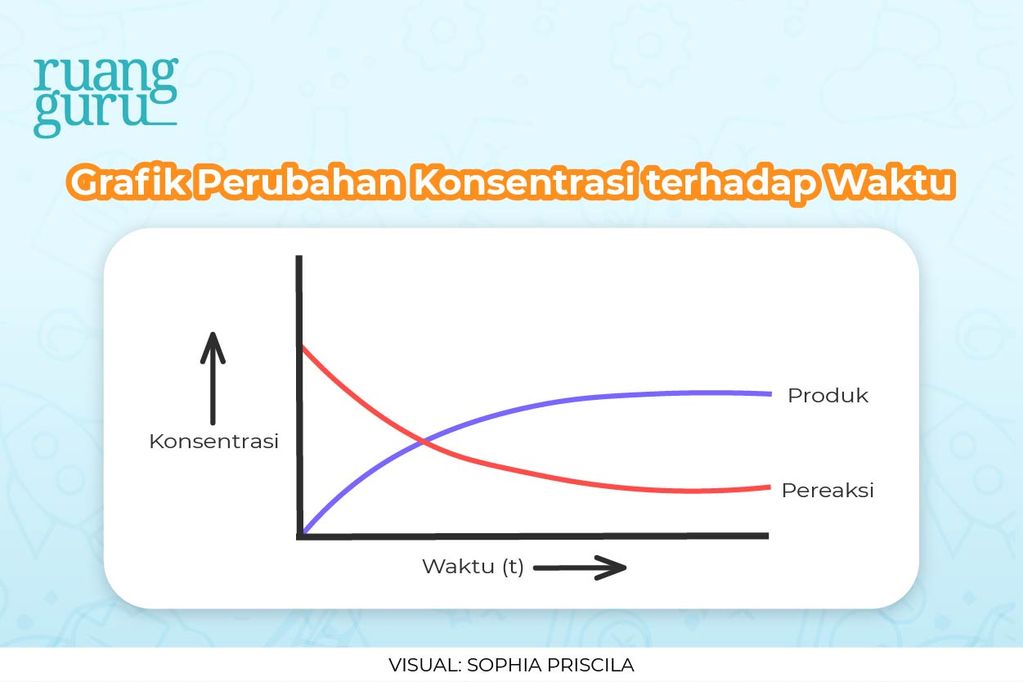
Laju reaksi merupakan perubahan konsentrasi dari reaktan atau produk terhadap waktu (satuan M/s). Beberapa reaksi yang terjadi di alam ada yang berlangsung sangat cepat atau sangat lambat. Contoh reaksi yang berlangsung sangat cepat yaitu reaksi fotosintesis dan reaksi berantai nuklir yang memerlukan rentang waktu 10 -12 s sampai 10 -16 s.

Chemistry Media Teori Tumbukan Pada Laju Reaksi, Energi Aktivasi, Kecepatan, Contoh, Grafik, Kimia
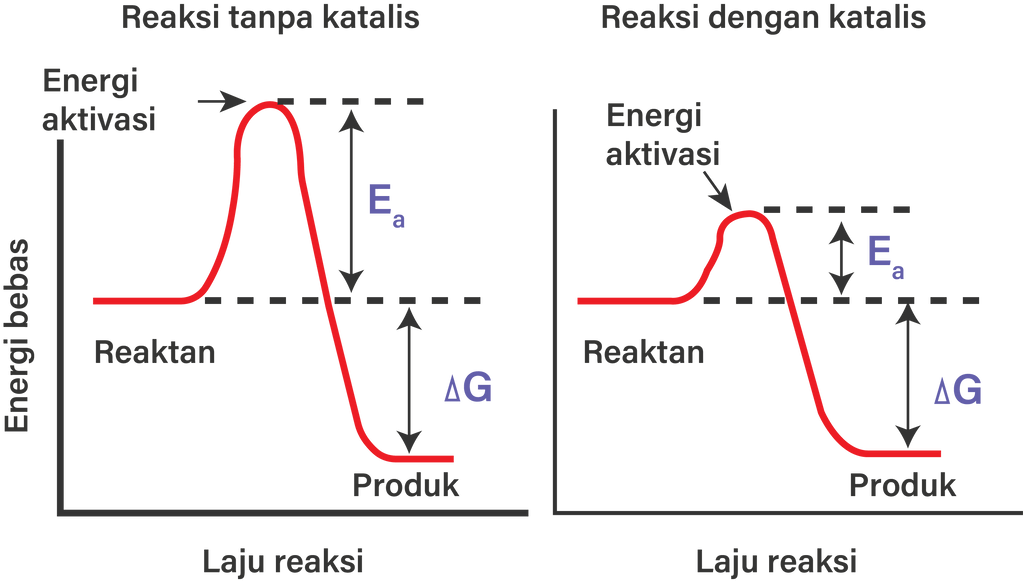
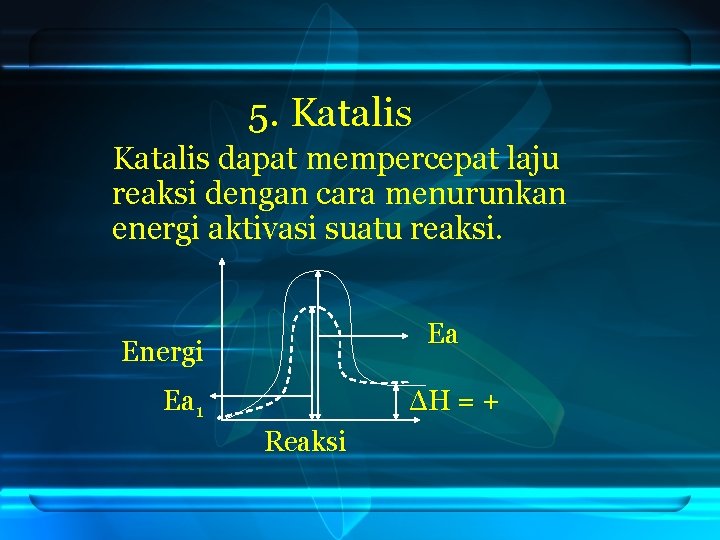
Katalis merupakan zat yang dapat mempercepat laju reaksi dengan cara menurunkan energi aktivasi (Ea) tanpa mengubah hasil reaksi (mencari jalan pintas yang lebih efisien). Energi aktivasi adalah energi minimum yang diperlukan untuk berlangsungnya suatu reaksi agar suatu reaktan berubah menjadi produk. Jadi, jawaban yang benar adalahD.

Pengaruh Katalis Terhadap Laju Reaksi
Jawabannya adalah tidak, penggunaan katalis tidak memberikan efek buruk pada reaksi melainkan memberikan efek baik pada reaksi tersebut. Dilansir dari Teknik Kimia Unversitas Diponegoro, katalis berfungsi untuk mempercepat laju reaksi tanpa mengganggu kesetimbangan reaksi tersebut. Pada laju reaksi yang sama, katalis dapat menyebabkan reaksi.

Pengertian dan Teori Laju Reaksi Materi Kimia Kelas 11 SoalB
Dalam penurunan energi aktivasi ini, maka energi minimum yang dibutuhkan untuk terjadinya tumbukan berkurang sehingga terjadinya reaksi berjalan cepat. Katalis pada umumnya mempunyai sifat-sifat sebagai berikut: aktivitas, stabilitas, selektivitas, umur, regenerasi dan kekuatan mekanik. Secara umum katalis mempunyai 2 fungsi yaitu mempercepat.

Penggambaran laju reaksi dengan dan tanpa adanya katalis
KOMPAS.com - Katalis adalah suatu zat yang dapat mempercepat terjadinya reaksi kimia tanpa dikonsumsi atau dipakai oleh reaksi tersebut. Selain mempercepat, katalis juga dapat menghemat energi yang digunakan untuk suatu reaksi kimia tanpa menganggu kesetimbangan reaksi. Karena sifatnya ini, katalis memiliki banyak manfaat bagi kehidupan di Bumi.

PPT LAJU REAKSI PowerPoint Presentation, free download ID4536189
1. Katalis. Pada kebanyakan reaksi yang berguna di bidang industri, reaksi akan berlangsung terlalu lambat tanpa bantuan katalis. Katalis adalah suatu zat yang dapat mempercepat laju reaksi namun tidak dikonsumsi atau dihabiskan dalam reaksi. Katalis dibedakan atas katalis homogen (satu fase dengan zat yang akan dikatalisis) dan heterogen.

PPT LAJU REAKSI PowerPoint Presentation, free download ID3356561
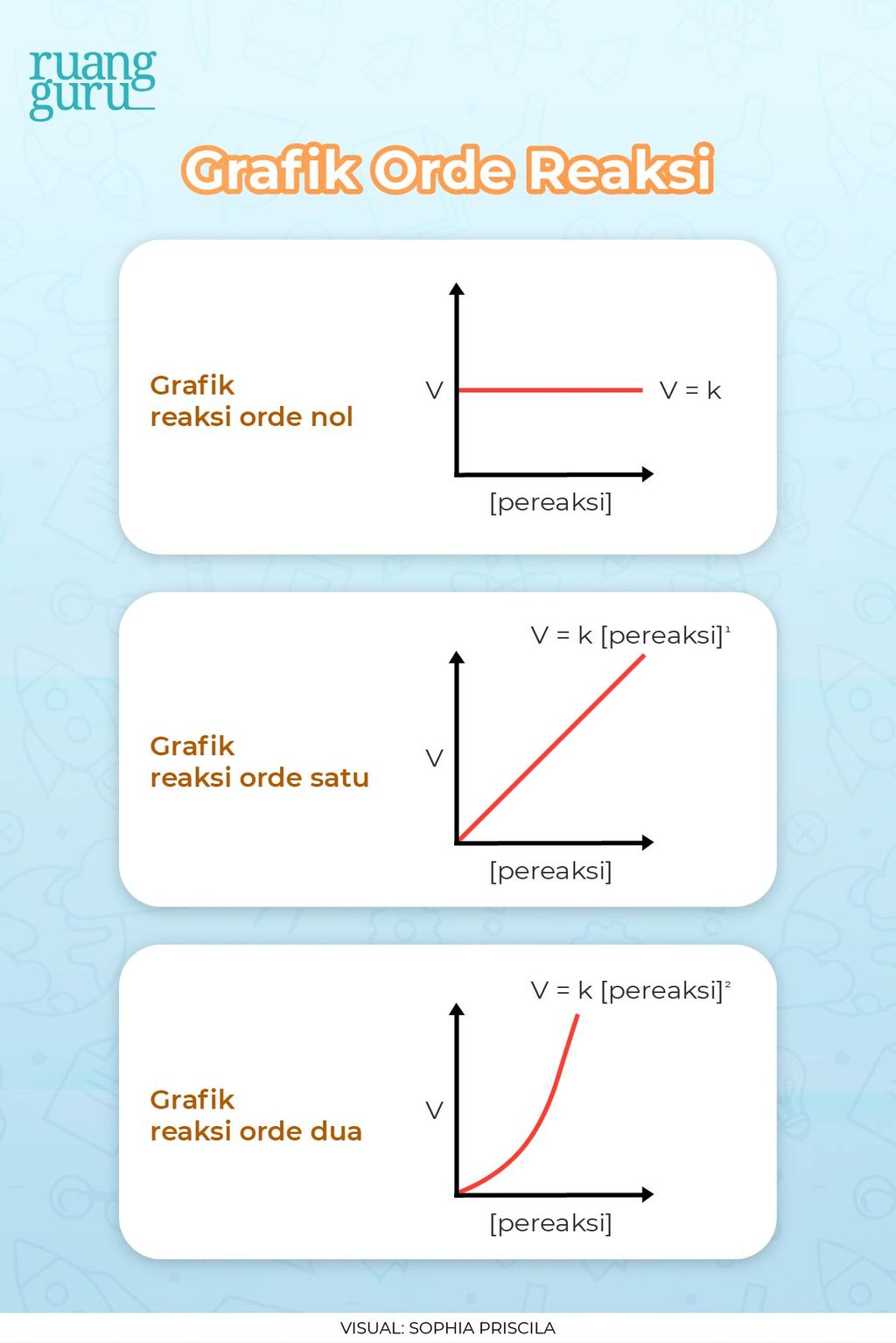
Berbagai faktor akan memengaruhi laju reaksi, seperti suhu, tekanan, keadaan zat, konsentrasi, dan katalis. Dengan pengetahuan tentang hukum laju reaksi dan bagaimana berbagai faktor dapat mempengaruhinya, kamu akan dapat mengontrol kondisi dalam suatu reaksi sehingga reaktan akan membentuk produk yang diinginkan dengan lebih cepat atau lambat.

Suatu katalis mempercepat reaksi dengan meningkatkan
Iklan. Pertanyaan. Fungsi katalis dalam mempercepat laju reaksi adalah. menurunkan suhu reaksi dengan memperbesar konsentrasi zat yang bereaksi. menurunkan energi aktivasi dan menaikkan energi potensial zat yang bereaksi. menaikkan suhu reaksi dengan memperbesar konsentrasi zat yang bereaksi.

Pengertian Katalis, Sifat, Jenis, Fungsi dan Contoh AAcial AAcial
Katalis memiliki fungsi utama untuk mempercepat laju reaksi dan menurunkan energi aktivasi dalam suatu proses kimia. Katalis bekerja dengan menyediakan jalur reaksi alternatif yang memiliki energi aktivasi yang lebih rendah dibandingkan dengan jalur reaksi tanpa katalis. Hal ini memungkinkan reaksi berlangsung lebih cepat dan efisien. Pembahasan
Tunjukkan dengan diagram, pengaruh katalisator ter...
Selain mempercepat laju reaksi, fungsi lain dari katalis adalah menurunkan energi aktivasi, yakni energi minimum yang perlu disediakan agar reaksi kimia dapat terjadi. Penjelasan Lebih Lanjut: Katalis kerjanya dengan cara memberikan jalur alternatif dengan energi aktivasi yang lebih rendah untuk suatu reaksi kimia.
Sarana Berbagi Ilmu Pengaruh katalis terhadap laju reaksi
Fungsi Katalis. Mengutip sumber lain dalam Rangkuman Rumus Matematika, Fisika, dan Kimia oleh Redaksi Kawan Pustaka, fungsi dari katalis yaitu memberi jalan baru dari suatu reaksi kimia, sehingga reaksi zat tersebut bisa lebih cepat. Dalam buku Kinetika Kimiawi oleh, mempercepat laju reaksi sendiri, pengaruh katalis terkait dengan energi pengaktifan reaksi (Ea).

Laju Reaksi LAJU REAKSI TEORI TUMBUKAN DARI LAJU
Setelah berhasil membantu proses laju reaksi, zat tersebut dapat kembali ke keadaan semula dan digunakan dalam reaksi selanjutnya. Inilah yang disebut dengan proses regenerasi katalis. 6. Mempengaruhi Kecepatan Reaksi. Zat tambahan ini dapat mempercepat laju reaksi dengan mengurangi waktu yang diperlukan untuk mencapai keseimbangan.
LAJU REAKSI Laju reaksi Berkurangnya konsentrasi pereaksi persatuan
Katalis pada umumnya mempunyai sifat-sifat sebagai berikut: aktivitas, stabilitas, selektivitas, umur, regenerasi dan kekuatan mekanik. Secara umum katalis mempunyai 2 fungsi yaitu mempercepat reaksi menuju kesetimbangan atau fungsi aktivitas dan meningkatkan hasil reaksi yang dikehendaki atau fungsi selektivitas.

PPT LAJU REAKSI PowerPoint Presentation, free download ID4536189
Katalis merupakan zat yang dapat mempercepat laju reaksi. Katalis mempercepat reaksi dengan cara menurunkan energi aktivasi (Ea). Energi aktivasi adalah energi yang dibutuhkan oleh zat-zat pereaksi untuk membentuk keadaan transisi. Dalam kata lain, energi aktivasi adalah energi yang dibutuhkan zat-zat pereaksi untuk bereaksi dan membentuk produk.

LAJU REAKSI By Indriana Lestari LAJU REAKSI meliputi
Mengenal Pengertian dan Fungsi Katalis. Katalis merupakan salah satu istilah yang ada dalam pembahasan ilmu kimia. Biasanya, istilah ini merujuk pada suatu zat yang dapat mempercepat atau memperlambat reaksi. Hal tersebut sebagaimana makna katalis yang terdapat dalam Kamus Besar Bahasa Indonesia (KBBI). Menurut KBBI, katalis adalah zat yang.
Laju Reaksi dan FaktorFaktor yang Memengaruhinya Kimia Kelas 11
1. Mempercepat Laju Reaksi Kimia. Katalis memiliki fungsi untuk mempercepat reaksi dan dapat berlangsung dalam suhu kamar. Sementara itu, tanpa adanya katalis maka reaksi yang dapat terjadi pada suhu yang berlangsung hingga 250°C. Kemampuan katalis digunakan untuk meningkatkan kecepatan reaksi kimia dengan cara yang lebih ekonomis.